La stragrande maggioranza dei materiali presenti in natura, nella nostra società e nei nostri corpi non sono sostanze pure, ma, di fatto, miscele di due o più sostanze.
Sebbene ci riferiamo, il più delle volte, all'acqua minerale solo come “acqua”, in realtà non contiene solo la sostanza pura H2O, perché è il risultato di un processo in cui l'acqua piovana penetra nel terreno e attraversa varie rocce.
Quindi, come suggerisce il nome, oltre all'acqua, ha anche diversi minerali disciolti. Se sei curioso di controllare l'etichetta di qualsiasi acqua minerale, vedrai che ha nella sua composizione chimica solfati di stronzio, calcio, sodio, potassio, bicarbonato di sodio, fluoruro di sodio, tra altri.
Mappa mentale: miscele
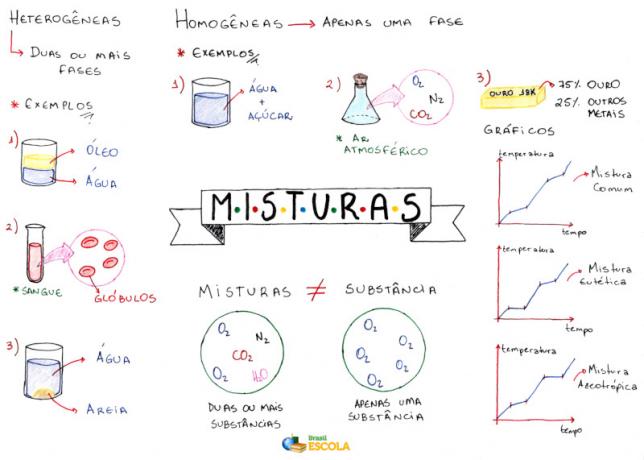
* Per scaricare la mappa mentale in PDF, Clicca qui!
Come è possibile differenziare una sostanza da una miscela?
L'acqua distillata mostrata di seguito è una sostanza pura che contiene solo H2O:

Acqua distillata utilizzata in laboratorio
Visivamente, sembra esattamente una miscela di acqua e sale; tuttavia, possono essere differenziati dalla definizione di blend. Guarda:
→ miscele sono materiali le cui proprietà fisiche non sono costanti, ma variano ad una certa temperatura e pressione.
Quindi, basta misurare il Proprietà fisiche, come punti di fusione e di ebollizione e densità. Se sono costanti e ben definiti, è a sostanza pura (nel caso dell'acqua distillata, a 4°C, la sua densità è 1,0 g/cm3 e, a livello del mare, i punti di fusione e di ebollizione sono rispettivamente 0°C e 100°C).
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Tuttavia, se vengono presentate variazioni, è una miscela. Se riscaldi la miscela acqua-sale per controllare il punto di ebollizione, vedrai che durante il passaggio dallo stato liquido a gas, la temperatura non rimane costante, come con l'acqua distillata, che rimane a 100 °C fino a quando tutto il liquido gira vapore.
Ora ci sono miscele che non è nemmeno necessario determinarne le proprietà fisiche per sapere che sono miscele, basta guardare, come nel caso della seguente miscela di acqua e olio:

Miscela formata da acqua e olio
Ciò indica che esistono diversi tipi di miscele, che possono essere classificate in omogeneo ed eterogeneo. Vedi ognuno:
Miscele omogenee:
Sono quelli che hanno un aspetto uniforme, con una sola fase (monofase). Esempi:
soluzione salina (0,9 g di cloruro di sodio in 100 ml di acqua);
salamoia (36 g di sali come cloruro di sodio, cloruro di magnesio, iodato di potassio, antiumettanti e 100 ml di acqua);
alcool idrato (etanolo e acqua);
aria (78% azoto gassoso, 20% ossigeno gassoso, 2% altri gas e vapore acqueo);
acciaio (lega metallica formata dal 98,5% di ferro e dall'1,5% di carbonio).

Salina, acciaio e formaldeide, esempi di miscele omogenee
Gli esempi sopra mostrano che miscele omogenee possono essere allo stato solido, liquido o gassoso. Queste miscele omogenee sono chiamate soluzioni e non possono essere separati con metodi fisici, ma solo con tecniche chimiche. Per separare l'alcol dall'acqua, ad esempio, è necessario eseguire un processo di distillazione, perché a centrifuga o filtrazione non andrebbe bene.
Inoltre, è importante sottolineare che devono essere omogeneo anche guardando sotto un ultramicroscopio. Ad occhio nudo, latte e sangue, ad esempio, possono apparire omogenei, ma all'ultramicroscopio vediamo che, di fatto, sono eterogeneo. Guarda l'immagine del sangue sotto l'ultramicroscopio e le sue fasi separate dopo che è stato posto in un'ultracentrifuga:
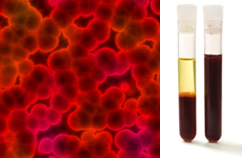
Immagine microscopica e fasi del sangue
Miscele eterogenee:
Sono quelli che hanno più di una fase. Esempi: acqua e olio, acqua e sabbia, ghiaccio e acqua, granito, acqua e ferro, sale non sciolto nell'acqua, ecc.
I componenti di miscele eterogenee appaiono, nella maggior parte dei casi, in diversi stati fisici e possono essere separati con metodi fisici. Un esempio si verifica quando facciamo il caffè e filtriamo il solido, separandolo dal liquido.
Ma non sempre ciò avviene, come dimostrato nel caso dell'olio e dell'acqua, che, pur essendo entrambi liquidi, non si dissolvono a causa delle diverse polarità delle sue molecole.
Mappa mentale Di Madre Victor Ricardo Ferreira
Insegnante di chimica
di Jennifer Fogaça
Laureato in Chimica