Calorelatente è la quantità di energiatermico che viene assorbito o ceduto da un corpo o sistema termodinamico, durante un cambiamento nel suo stato fisico, nel temperatura costante.
Quando una sostanza pura raggiunge la sua temperatura di Fusione o bollente, durante il riscaldamento, il tuo stato fisico inizia a cambiare. In questo processo, continua ad assorbire calore, tuttavia, la sua temperaturaresticostante. Questo accade perché, al raggiungimento di queste temperature, in cui si verificano cambiamenti di stato fisico, tutto il calore che viene assorbito dal sistema termodinamico viene utilizzato per superare energiapotenziale che tiene unite le sue molecole. Non appena il sistema termodinamico assorbe tutta l'energia necessaria per scomporre le sue molecole, l'interazione tra di esse diminuisce, indicando che il loro stato di aggregazione è cambiato. Dopo il cambiamento di stato fisico, il calore che è stato assorbito isotermico continua ad essere assorbito dalle molecole, fornendo loro
energiacinetica. Questo tipo di calore che aumenta l'energia cinetica delle molecole si chiama calore sensibile.Guardaanche: Sette consigli "oro" per uno studio di fisica più efficace
oh calorelatente misura la quantità di calore, per unità di massa, necessaria per qualsiasi variazione di stato fisico del corpo, quindi, sua unità di misura, secondo il Sistema Internazionale (SI), è il Jouleperchilogrammo (J/kg). Tuttavia, l'uso di altre unità come il caloriapergrammo (cal/g), è abbastanza comune nello studio della calorimetria.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Tipi di calore latente
Esistono due tipi di calore: o caloreSelivello è il calorelatente. Il calore sensibile è quello che viene trasferito tra i corpi quando ci sono variazioni di temperatura. Il calore latente, a sua volta, si verifica quando ci sono trasferimenti di calore senza variazioni di temperatura.
Il calore latente viene alterato per diversi cambiamenti di stato fisico. Scopri i diversi tipi di calore latente:
Calore latentenelfusione (LF): è il calore che viene assorbito o ceduto dai corpi durante il processo di fusione: da liquido a solido e viceversa, a temperatura costante.
Calore latentenelvaporizzazione (LV): è quello che viene trasferito durante le trasformazioni solido-liquido o liquido-solido, nel temperatura costante.
Guardaanche: Cos'è la capacità termica?
Esempinelcalorelatente
Scopri alcune situazioni quotidiane in cui ci sono scambi di calore latenti:
Quando riscaldiamo l'acqua, fino ad una temperatura di 100°C, inizia il processo di evaporazione. Finché tutta l'acqua non si trasforma in vapore, la sua temperatura non cambia.
Quando versiamo acqua su una superficie molto calda, tutta l'acqua evapora quasi istantaneamente. Questo processo è chiamato riscaldamento e comporta l'assorbimento del calore latente.
C'è uno scambio di calore latente quando tocchiamo una bottiglia di soda a basse temperature e tutto il suo contenuto gela velocemente a temperatura costante, grazie alla sua temperatura inferiore al punto di fusione dell'acqua.
formula calore latente
Il calore latente è calcolato dal rapporto tra la quantità di calore trasferita nella trasformazione isotermica:
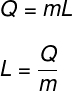
Q – quantità di calore trasferito
m - massa corporea
l - Calore latente
Cambiamenti di fase e calore latente
Si verificano cambiamenti di fase nelle sostanze pure neltemperaturacostante, assorbendo o rilasciando calore latente. Tutte le sostanze pure hanno a curva di riscaldamento simile all'immagine qui sotto:
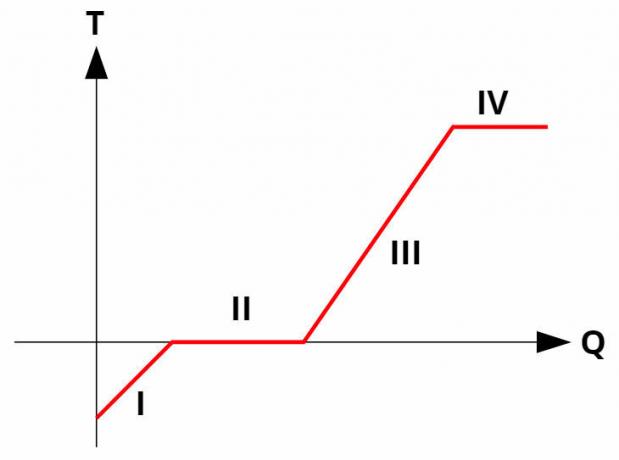
A curvenelriscaldamento mettono in relazione la temperatura (asse y) con la quantità di calore dato o ricevuto (asse x). Nei cambi di fase (processi II e IV), la temperatura rimane costante, sebbene vi sia ancora uno scambio termico.
Vedi anche: Fondamenti di calorimetria
tabella calore latente
In condizioni normali di temperatura e pressione, O calorelatente di acqua, per le sue diverse variazioni di stato fisico, è riportato nella tabella seguente:
Trasformazione |
Calore latente (cal/g) |
Fusione (0°C) |
80 |
Solidificazione (0°C) |
-80 |
Vaporizzazione (100°C) |
540 |
Condensa (100°C) |
-540 |
Secondo la tabella sopra riportata, 80calorie congelare 1 grammodi acqua alla temperatura di fusione (0°C). I segni negativi in processi di solidificazione e condensazione indicano che in essi è stato rilasciato calore, quindi queste due trasformazioni sono esotermico. La tabella seguente mostra il calore latente in J/kg, per gli stessi processi:
Trasformazione |
Calore latente (J/kg) |
Fusione (0°C) |
333.103 |
Solidificazione (0°C) |
-333.103 |
Vaporizzazione (100°C) |
2,2.106 |
Condensa (100°C) |
-2,2.106 |

esercizi di calore latente
1) Un contenitore contiene 500 g di acqua liquida. Senza variazioni della temperatura dell'acqua, tutto il suo contenuto viene improvvisamente evaporato. Determina quanto calore si è trasferito al contenuto di questo contenitore.
Dati: LF = 540 cal/g
Risoluzione:
Per calcolare la quantità di calore necessaria per far evaporare questa massa d'acqua, utilizzeremo la seguente formula:
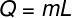
Utilizzando i dati forniti dall'esercizio, eseguiremo il seguente calcolo:
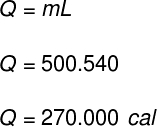
Di Me. Rafael Helerbrock
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
HELERBROCK, Rafael. "Calore latente"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/fisica/calor-latente.htm. Consultato il 27 giugno 2021.