isomero geometrico è una specie di isomeria spaziale che valuta e confronta la posizione nello spazio dei leganti di due atomi di carbonio in una catena. Questa valutazione è fatta da un piano immaginario tra i carboni coinvolti.
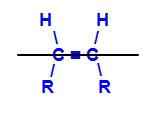
Piano immaginario che divide la molecola
Il piano immaginario nella struttura sopra divide la molecola in un piano superiore e in un piano inferiore. Con questo, possiamo valutare e confrontare i ligandi di carbonio coinvolti in ciascuno di questi piani. Vedi i tipi di isomeri geometrici:
→ Isomero geometrico cis-trans
Un composto ha isomeria geometrica cis-trans quando la catena visualizza:
Catena aperta con un doppio legame tra due atomi di carbonio, che hanno gli stessi link tra loro. Vedi un esempio:
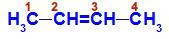
Formula di struttura del But-2-ene
Nella struttura possiamo osservare che sia il carbonio 2 che il carbonio 3 hanno gli stessi ligandi, che sono idrogeno (H) e metile (CH3).
Catena chiusa con due atomi di carbonio che hanno gli stessi ligandi tra loro. Vedi un esempio:
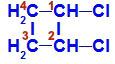
Formula strutturale di 1,2-dicloro-ciclobutano
Nella struttura possiamo osservare che sia il carbonio 1 che il carbonio 2 hanno gli stessi ligandi, che sono idrogeno (H) e cloro (Cl).
Per spiegare l'isomerismo cis-trans, useremo but-2-ene:
a) isomero cis: è l'isomero geometrico in cui gli stessi leganti occupano lo stesso piano. Nell'esempio seguente, gli idrogeni sono sullo stesso piano, così come i radicali metilici.

Formula di struttura di cis-but-2-ene
b) isomero trans: è l'isomero geometrico in cui diversi ligandi occupano lo stesso piano. Nell'esempio sotto, abbiamo sullo stesso piano un idrogeno e un metile (CH3).
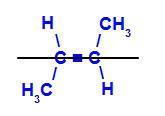
Formula di struttura del trans but-2-ene
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
→ E-Z isomero geometrico
Un composto ha isomeria geometrica E-Z quando la catena ha:
Catena aperta con un doppio legame tra due atomi di carbonio, che hanno tutti o alcuni linker diversi. Vedi un esempio:
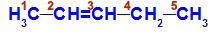
Formula di struttura del pent-2-ene
Nella struttura, possiamo vedere che il carbonio 2 ha il legante metilico (CH3) e idrogeno (H), e il carbonio 3 ha il legante idrogeno (H) ed etile (H))3C-CH2).
Catena chiusa con due atomi di carbonio che hanno tutti o alcuni ligandi diversi tra loro. Vedi un esempio:
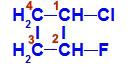
Formula strutturale di 1-cloro-2-fluoro-ciclobutano
Nella struttura, possiamo osservare che il carbonio 1 ha idrogeno e cloro come ligandi principali e il carbonio 2 ha idrogeno e fluoro come ligandi principali.
NOTA: Tra i diversi ligandi, nell'isomerismo geometrico, valutiamo la complessità del ligando (numero di atomi) o il numero atomico.
Per spiegare l'isomero EZ, useremo sia pent-2-ene che 1-cloro-2-fluoro-ciclobutano:
a) E-isomero
isomero geometrico dove i leganti più complessi o con il numero atomico più alto sono posizionati su piani opposti. Nell'esempio seguente, il legante più complesso sul carbonio 2 è il metile e il legante più complesso sul carbonio 3 è l'etile, che sono posizionati su piani diversi.
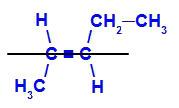
Formula strutturale di E-pent-2-ene
b) Isomero Z
isomero geometrico dove i leganti più complessi o con il numero atomico più alto sono posizionati sullo stesso piano. Nell'esempio seguente, il legante con numero atomico più alto del carbonio 1 è il cloro (Z = 17) e il legante con numero atomico più alto del carbonio 2 è il fluoro (Z = 9), che sono posizionati sullo stesso piano.
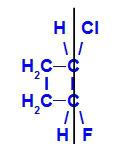
Formula strutturale di Z-1-cloro-2-fluoro-ciclobutano
Di Me. Diogo Lopes Dias
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
GIORNI, Diogo Lopes. "Cos'è l'isomerismo geometrico?"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria-geometrica.htm. Consultato il 28 giugno 2021.
Chimica
Conoscere i vari tipi di isomeri piani e spaziali, come funzione, posizione, catena, tautomerismo, metamerismo, isomeria geometrica e ottica cis-trans.