Acidi e basi sono due funzioni chimiche considerate opposte., questo perché le loro proprietà sono generalmente inverse. Ad esempio, se consideriamo acidi gli alimenti presenti nella nostra vita quotidiana, vedremo che il loro sapore, in generale, è aspro, come avviene con il limone. Tuttavia, i cibi di base hanno un sapore astringente (che "lega" la bocca), come una banana verde.
Ma identificare una sostanza come acida o basica solo dal gusto, oltre ad essere un metodo che ha molte possibilità di fallire, è anche molto pericoloso in quanto ci sono molti acidi e basi che sono forti, tossici e possono anche uccidere, come l'acido. solforico (H2SOLO4), utilizzato nelle batterie delle automobili, e l'idrossido di sodio (NaOH), commercialmente noto come soda caustica.
Pertanto, le proprietà organolettiche (proprietà che riguardano i nostri sensi, come il gusto e l'olfatto) non sono quelle utilizzate per identificare acidi e basi. Notare di seguito altre proprietà di queste funzioni organiche che servono a confrontarle e distinguerle:
- Solubilità in acqua:
voi acidi di solito stai bene solubile in acqua, mentre la maggior parte basi é insolubile. Le basi di metalli alcalini sono solubili, le basi di metalli alcalino-terrosi sono scarsamente solubili e le basi di altri metalli sono insolubili (un'eccezione è l'idrossido di ammonio, NH4OH, che esiste solo in soluzione acquosa, fa gorgogliare il gas ammoniacale in acqua ed è quindi solubile in essa).
Quando diciamo "insolubili", intendiamo che queste sostanze sono praticamente insolubili, perché nessuna sostanza è completamente insolubile in acqua.
- Struttura:
Tutti i gli acidi sono molecolari, cioè formati da legami covalenti in cui gli elettroni sono condivisi. Un esempio è il gas cloridrico, che si forma condividendo una coppia di elettroni tra idrogeno e cloro:

già il le basi possono essere ioniche o molecolari. Quelli con metalli alcalini e alcalino terrosi sono ionici e gli altri sono molecolari.
Esempi:
NaOH: base ionica formata da ioni Na+ e oh-;
NH4OH: base molecolare dell'ammoniaca in acqua.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
- Conducibilità elettrica:
Tutti gli acidi conducono corrente elettrica solo quando sono disciolti in acqua, perché quando sono in un mezzo acquoso, subiscono la ionizzazione, cioè rilasciano ioni.
Esempio:
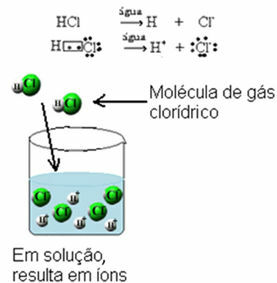
Tutti le basi conducono anche corrente elettrica in soluzione., in quanto quelli ionici vanno incontro a dissociazione (rilasciano gli ioni già presenti nella formula) e quelli molecolari subiscono ionizzazione, reagendo con l'acqua e rilasciando ioni. A Le basi di metalli alcalini conducono anche corrente elettrica quando sono allo stato liquido (fuso).
- Azione sugli indicatori:
voi indicatori acido-base sono sostanze naturali o sintetiche che subiscono un cambiamento di colore quando entrano in contatto con un acido o una base. Se un acido fa cambiare colore all'indicatore, la base riporterà l'indicatore al suo colore originale e viceversa.
Ad esempio, la fenolftaleina è un indicatore acido-base ampiamente utilizzato e in un mezzo basico diventa un rosa molto intenso; già in un mezzo acido, diventa incolore. Anche la cartina di tornasole è un buon indicatore, poiché in un acido diventa rossa; e su una base diventa blu.
Questo serve anche per indicare la differenza di pH che esiste tra acidi e basi.
- PH:
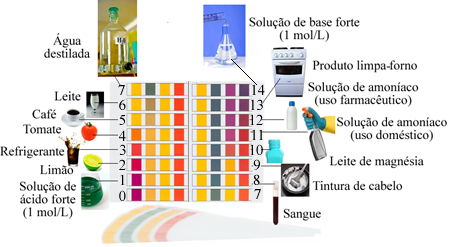
Un mezzo considerato neutro ha un pH pari a 7, come nel caso dell'acqua distillata.
Gli acidi hanno un pH inferiore a 7, Mentre le basi hanno un pH maggiore di 7.
Esempi di soluzioni con un pH prossimo a quello indicato dalla scala:
- Azione reciproca:
Quando posti a contatto, acidi e basi reagiscono tra loro, neutralizzandosi a vicenda, cioè rendendo neutro il pH del mezzo. Questo perché il catione H+ dall'acido reagisce con l'anione OH- dalla base, formando acqua. Questo tipo di reazione è chiamato a reazione di neutralizzazione e produce anche un sale.
di Jennifer Fogaça
Laureato in Chimica