A forze intermolecolari, genericamente chiamato Forze di Van der Waals, ce ne sono tre: dipolo indotto dipolo indotto, legami idrogeno e dipolo permanente-dipolo permanente. In questo testo, prenderemo in considerazione solo l'ultima di queste tre forze:
Il potere dipolo permanente-dipolo permanente, o semplicemente, dipolo-dipolo si verifica solo in molecole polari, cioè quelli che non hanno una distribuzione uniforme del carico lungo la sua superficie. Per citare un esempio, nella molecola di HCl (gas cloridrico) la nuvola elettronica è più spostata verso l'atomo di cloro, in quanto più elettronegativa dell'idrogeno.
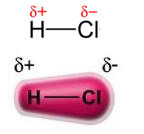
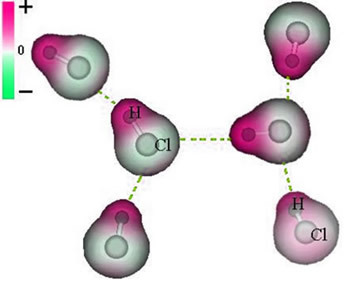
Si noti che attorno all'atomo di cloro c'è un accumulo di elettroni, che provoca la formazione di a polo negativo, che è simboleggiato dalla lettera greca delta (-δ). Di conseguenza, nella regione intorno all'atomo di idrogeno a polo positivo (+δ), in quanto ha una bassa densità elettronica. La molecola di HCl costituisce quindi a dipolo elettrico e, quindi, quando si entra in contatto con altre molecole di HCl vicine, c'è una forza di attrazione tra i poli opposti delle molecole, come si può vedere di seguito:
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Questa forza attrattiva, che si stabilisce tra l'estremità negativa del dipolo di una molecola con l'estremità positiva del dipolo di un'altra molecola, costituisce la forza dipolo-dipolo..
Quindi, come dice il nome, il dipolo è permanente, quindi si verifica solo nei composti polari. E maggiore è la polarità di una molecola, più intense sono le interazioni dipolo-dipolo nella sostanza.
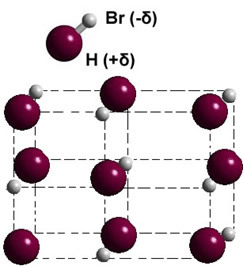
Se è in fase solida, la formazione del dipolo permanente guida la posizione di ogni molecola nello spazio, formando cristalli dipolari; come nel caso dell'acido bromidrico illustrato di seguito:
Altri esempi di sostanze polari che hanno la forza dipolo-dipolo tra le loro molecole sono: H2S, CO, HCCl3, SOLO2.
Questa forza intermolecolare è di intensità media, poiché è più forte della forza di attrazione del dipolo indotta dal dipolo indotto, ma meno intensa del legame idrogeno. Questo è il motivo per cui i loro punti di fusione e di ebollizione sono superiori a quelli delle sostanze che hanno una forza dipolo indotta. Poiché la forza del dipolo permanente è più forte, è necessario fornire più energia affinché le interazioni delle sue molecole si rompano.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Forza intermolecolare dipolo-dipolo"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm. Consultato il 27 giugno 2021.
e) OS2, HBr, HCl, H2O.
c) Sapendo che le temperature di ebollizione di CH3Cl e CH3I sono rispettivamente 24,0 °C e 42,4 °C, indicano quale composto presenta, nella fase liquida, forze intermolecolari più intense.



