succede a trasformazioneisocora quando una data massa di un gas subisce variazioni di temperatura che innescano variazioni di pressione o viceversa, considerando che temperatura e pressione, in questo caso, sono quantità direttamente proporzionali, mentre il volume del sistema rimane invariato.
Vedi anche: Qual è la pressione parziale dei gas?
Che cos'è una trasformazione isocora?
Una trasformazione isocora si ha quando si verifica un cambiamento di temperatura e pressione su una data massa di gas, ma il suo volume rimane lo stesso. La variazione di pressione sarà direttamente proporzionale alla temperatura, cioè se un gas, in un certo sistema chiuso, raddoppia la sua temperatura assoluta, ciò provocherà un aumento della pressione al doppio di quanto era inizialmente.
Questo tipo di trasformazione è anche chiamato isovolumetrico o isometrico. Il termine isocoro deriva dal greco Isokhora, su cosa iso significa "uguale" e khora significa "luogo o volume" (in questo contesto).
Esempi:
Le gomme di un'auto subiscono una trasformazione isocora, possiamo osservarlo quando facciamo la sua
calibrazione. Nelle giornate calde la pressione indicata sul monitor di calibrazione è maggiore rispetto alle giornate fredde. Questo perché, all'aumentare della temperatura, la pressione aumenta, poiché il volume rimane.
Altri esempi sono i deodoranti spray, in questa tipologia di prodotto è presente in etichetta l'avvertenza di non essere conservato o sottoposto ad alte temperature, perché, oltre ad alcune sue sostanze essendo infiammabili, vi è la condizione di trasformazione isocora o isovolumetrico. Poiché i deodoranti aerosol sono all'interno di un flacone sigillato e allo stato gassoso, il l'aumento della temperatura porterà ad un aumento della pressione e al rischio di un'esplosione.
Caratteristiche di una trasformazione isocora
- Volume costante.
- Pressione e temperatura sono direttamente proporzionali.
Queste caratteristiche possono essere descritte dalle seguenti formule:

Grafico di una funzione isocora
Si noti la tabella seguente che descrive il comportamento di un gas in relazione alla pressione, alla temperatura e alla costante risultante.
Temperatura (°C) |
Pressione (atm) |
P/T = costante |
50 |
5 |
10 |
100 |
10 |
10 |
150 |
15 |
10 |
200 |
20 |
10 |
Si noti che la pressione segue l'aumento della temperatura in modo che il rapporto P/T rimanga costante, il che significa che pressione e temperatura sono quantità direttamente proporzionali. Pertanto, il grafico che descrive le trasformazioni isocore è di tipo lineare. Guarda:

Chi ha scoperto la trasformazione isocora?
Jacques Alexandre César Charles (1746-1823) fu lo scienziato francese che, studiando il comportamento dei gas in un sistema chiuso per la realizzazione di un termometro di precisione, concluse gli studi sulle trasformazioni isocore.
Lo scienziato Joseph Louis Gay-Lussac (1778-1850) sviluppò anche uno studio sull'espansione e il ritiro di un sistema gassoso. Si trattava di analisi indipendenti, ma poiché giunsero alla stessa conclusione, divisero i crediti. Oggi alcuni autori fanno riferimento alle ultime due leggi fisiche dei gas che spiegano il trasformazioni isobariche e isocora come 1° e 2° legge di Charles-Gay-Lussac.
Vedi anche: Legge volumetrica di Gay-Lussac
Esercizirisolto
Domanda 1 - (PUC-RJ) Un pneumatico per bicicletta viene tarato ad una pressione di 4 atm, in una giornata fredda, ad una temperatura di 7 °C. Il volume e la quantità di gas iniettato sono gli stessi. Quale sarà la pressione di taratura nel pneumatico quando la temperatura raggiunge i 37°C?
a) 21,1 atm
b) 4,4 atm
c) 0,9 atm
d) 760 mmHg
e) 2,2 atm
Risoluzione
Alternativa A
1° passo: identificare il sistema ed estrarre i dati.
Sistema isovolumetrico
P1 = 4 atm
T1 = 7°C
T2 = 37°C
P2 = ?
Usando la formula:
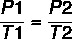
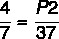
7 x P2 = 37 x 4
P2 = 148 / 7
P2 = 21,14 atm
Domanda 2 - (Unifor-CE) Esaminare la figura sottostante.
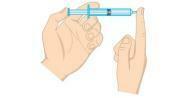
La pressione del gas all'interno della siringa può essere ridotta:
a) immergere la siringa in acqua ghiacciata, mantenendo l'estremità chiusa.
b) schiacciare lo stantuffo, mantenendo l'estremità chiusa.
c) immergere la siringa in acqua calda, mantenendo l'estremità chiusa.
d) aprire la punta ed espellere metà dell'aria dalla siringa.
e) tirare lo stantuffo, mantenendo l'estremità aperta.
Risoluzione
Alternativa A. La pressione di un gas è direttamente proporzionale alla temperatura in un sistema isocoro, cioè senza modificare il volume o la massa del gas. Quando c'è una diminuzione della temperatura, ci sarà anche un calo della pressione.
Di Laysa Bernardes Marques de Araujo
Insegnante di chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/transformacao-isocorica.htm
