IL entalpia di formazione, chiamato anche entalpia standard di formazione, o calore standard di formazione, è il calcolo del calore ceduto o assorbito nella formazione di 1 mole di sostanza da sostanze semplici, allo stato standard.
È impossibile calcolare il valore assoluto delle entalpie di ciascuna sostanza, ma è possibile calcolare la variazione dell'entalpia che si verifica nella reazione mediante un calorimetro.
È necessario ricordare che si è convenuto di adottare il valore di entalpia pari a zero per le sostanze semplici allo stato standard. Quindi, se vogliamo scoprire qual è l'entalpia di formazione di una sostanza, dobbiamo solo conoscere il valore dell'entalpia della sua reazione di formazione da sostanze semplici.
Ad esempio, vogliamo trovare l'entalpia di 18 grammi di acqua, che corrisponde a 1 mol, poiché la sua massa molare è 18 g/mol. Per fare ciò, abbiamo prima bisogno della reazione per formare acqua da sostanze semplici, come mostrato di seguito:
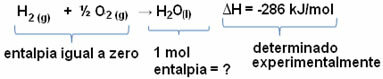
Si noti che il valore della variazione di entalpia avvenuta in questa reazione è stato determinato sperimentalmente mediante un calorimetro ed è pari a -286 kJ/mol.
La formula che calcola questa variazione di entalpia (ΔH) è:
H = HProdotti - HReagenti
Quindi, poiché sappiamo già il valore di ΔH e che l'entalpia dei reagenti è pari a zero (essendo sostanze semplici allo stato standard), possiamo quindi concludere che il valore di entalpia di 1 mol di acqua è uguale alla variazione di entalpia della reazione di formazione, poiché è l'unico prodotto di quella reazione, come mostrato sotto:
H = HProdotti - HReagenti
-286 kJ/mol = HH2O - (HH2 + H1/2 oh2)
-286 kJ/mol = HH2O - 0
HH2O = - 286 kJ/mol
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Questo tipo di entalpia, ottenuta dall'entalpia di sostanze semplici allo stato standard, è quindi la entalpia standard di formazione (ΔH0).
Ora, ci sono molte sostanze che non sono formate direttamente da una singola reazione, come l'acqua. In tali casi, l'entalpia di formazione può essere calcolata dalla variazione di entalpia della reazione.
Ad esempio, NH4Cl è formato dalla seguente reazione:
NH3 + HCl → NH4Cl H = -176 kJ/mol
Nota che nessuno dei reagenti è una sostanza semplice, quindi non possiamo assegnare loro un'entalpia pari a zero. Dobbiamo conoscere le entalpie di formazione di ciascuno dei reagenti, poiché queste sono formate da reazioni tra sostanze semplici:
NH3: H = -46 kJ/mol
HCl: ΔH = -92,4 kJ/mol
Sommando queste due entalpie si ottiene il valore dell'entalpia dei reagenti e si trova l'entalpia di NH4Cl:
HR = HNH3 + HHCl
HR = (-46 + (-92,4) kJ/mol)
HR = -138,4 kJ/mol
Sostituendo nella formula:
H = HProdotti - HReagenti
-176 = HNH4Cl - ( -138,4)
HNH4Cl = - 176 - 138,4
HNH4Cl = -314,4 kJ/mol
In questo caso abbiamo sommato direttamente i valori delle entalpie di formazione dei reagenti perché il rapporto di reazione era solo di 1 mol. Tuttavia, se in altre reazioni la quantità di moli è diversa, sarà necessario prima moltiplicare l'entalpia di formazione del reagente per il numero di moli.
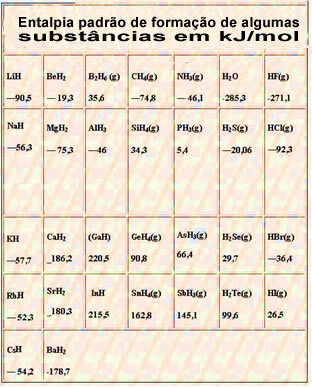
Di seguito una tabella con l'entalpia standard di formazione di alcune sostanze a 25 °C e 1 atm:
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Entalpia di Formazione"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm. Consultato il 27 giugno 2021.



