Le celle, o celle elettrochimiche, e le batterie sono dispositivi in cui l'energia chimica si trasforma spontaneamente in energia elettrica.La cella è composta da soli due elettrodi e un elettrolita, mentre la batteria è un insieme di batterie in serie o in parallelo.
A le batterie primarie sono dispositivi non ricaricabili, essendo che quando cessa la reazione di ossidoriduzione che avviene al loro interno, devono essere scartati.
Per ogni apparecchiatura è indicato un tipo di batteria e, tra le batterie primarie attualmente utilizzate, le principali sono: Pile a secco Leclanché (pile comuni o pile ad acido), pile alcaline e pile al litio/biossido di manganese.
Scopri cosa li distingue e per quale attrezzatura sono adatti:
- Celle a secco Leclanché:
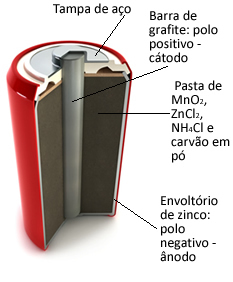
Tali pile sono sostanzialmente costituite da un involucro di zinco, separato da una carta porosa e da una barra centrale di grafite circondata da biossido di manganese (MnO2), carbone in polvere (C) e una pasta umida contenente cloruro di ammonio (NH4Cl), cloruro di zinco (ZnCl2) e acqua (H2O).
oh zinco funziona come anodo, perdendo elettroni; è il grafite funziona come catodo, conducendo elettroni al biossido di manganese:
Mezza reazione anodica: Zn (S) → Zn2+(Qui) + 2 e-
Semi-reazione catodica: 2 MnO2(ac) + 2 NH41+(Qui) + 2e- → 1 Mn2oh3(S) + 2NH3(g) + 1 ora2oh(1)
Reazione globale: Zn (S) + 2 MnO2(ac) + 2 NH41+(Qui) → Zn2+(Qui) + 1 Mn2oh3(i) + 2NH3(g)
Questo tipo di batteria è adatto per apparecchiature che richiedono una scarica leggera e continua, come telecomando, orologio da parete, radio portatile e giocattoli.
Puoi ottenere maggiori dettagli sull'origine, il funzionamento, la durata, il ddp, i pericoli e le precauzioni che devono essere prese con queste batterie nel testo "Pila a secco Leclanché”.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
- Batterie alcaline:
Il suo funzionamento è molto simile a quello delle celle a secco Leclanché, però l'unica differenza è che al posto del cloruro ammonio (che è un sale acido), viene aggiunta una base forte, principalmente idrossido di sodio (NaOH) o idrossido di potassio (KOH).
Mezza reazione anodica: Zn + 2 OH → ZnO + H2O + 2e-
Semi-reazione catodica: 2 MnO2 + H2O + 2e-→ Mn2oh3 + 2 OH
Reazione complessiva: Zn +2 MnO2→ ZnO + Mn 2oh3

Le batterie alcaline sono più vantaggiose di quelle acide nel senso che hanno una durata maggiore, in in genere forniscono il 50-100% in più di energia rispetto a una normale batteria della stessa dimensione, inoltre c'è meno pericolo di perdite.
Sono principalmente indicati per dispositivi che richiedono download veloci e più intensi, come radio, lettori CD/DVD e MP3 portatili, torce elettriche, fotocamere digitali, ecc.
Leggi anche il testo Batterie alcaline.
- Batterie al litio/biossido di manganese:
Queste batterie sono leggere e generano una grande tensione (circa 3,4 V), motivo per cui vengono spesso utilizzate in piccole apparecchiature come orologi e calcolatrici. A differenza dei casi precedenti, il suo formato è valuta, come mostrato nell'immagine seguente:

L'anodo è il litio, il catodo è il biossido di manganese e l'elettrolita è una soluzione salina:
Mezza reazione anodica: leggere →leggere+ + e−
Semi-reazione catodica: MnO2 + leggi+ + e−→MnO2(li)
Reazione generale: Li + MnO2 → MnO2(li)
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Tipi più comuni di celle e batterie primarie"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/tipos-pilhas-baterias-primarias-mais-comuns.htm. Consultato il 27 giugno 2021.



