IL ponte di sale fu proposto dal chimico inglese Frederic Daniell, nel 1836, quando questo studioso istituì il batteria prende il nome da lui (Danill's Pile). questo ponte è un tubo a forma di U che ha due estremità porose. (costituito da cotone o agar-agar) e contiene una soluzione acquosa formata da acqua e un sale. Collega indirettamente le soluzioni delle due semicelle della cella (anodo e catodo).
Osservazione: L'anodo è il polo negativo della batteria ed è dove si verifica l'ossidazione, e il catodo è il polo positivo e dove si verifica la riduzione.
Per comprendere l'importanza del ponte salino è necessario inizialmente comprendere il funzionamento del palo. Vedi lo schema qui sotto:
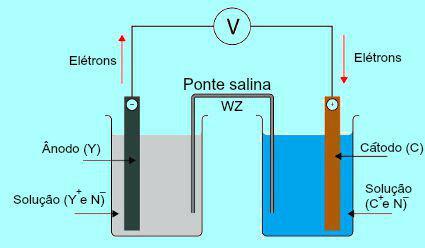
Schema generale di uno stack Daniell
Inizialmente, il metallo (Y) della piastra presente nell'anodo subisce ossidazione. Quando subisce l'ossidazione, il metallo si trasforma in catione, che cade nella soluzione in cui si trova la piastra. Per questo motivo la soluzione anodica inizia a presentare una maggiore concentrazione di cationi (Y
+). In questo caso, si osserva una diminuzione della piastra metallica dell'anodo.
Y → e- + Sì+
Quindi, gli elettroni persi durante l'ossidazione del metallo della piastra anodica viaggiano attraverso il filo elettrico esterno e vanno alla piastra metallica presente nel catodo. Pertanto, la piastra presente al catodo si carica di elettroni.
-
I presenti cationi (C+) nella soluzione si spostano verso la piastra del catodo perché è carica di elettroni. I cationi, acquistando gli elettroni presenti nella lastra, diventano neutri (stabili e solidi) e vi aderiscono. Per questo motivo la soluzione catodica presenta una maggiore concentrazione di anioni rispetto a quella di cationi. In questo caso, si osserva un aumento delle dimensioni della piastra metallica del catodo.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Ç+ + e- → C
Dalla comprensione di come il Il mucchio di Daniell, è possibile osservare che la soluzione presente nell'anodo riceve una maggiore quantità di cationi Y+ a causa dell'ossidazione del metallo della piastra X. La soluzione presente nel catodo, invece, perde i suoi cationi (C+) perché soffrono di riduzione della placca.
È proprio su questo tema che si evidenzia l'opera del ponte di sale. La funzione principale di questo ponte è quella di favorire l'equilibrio delle cariche presenti sia nella soluzione anodica che catodica. Nel ponte salino abbiamo sempre un sale (solitamente cloruro di potassio o nitrato di ammonio.) dissociato in acqua. Vedere la rappresentazione di un'equazione nel ponte salino:
WZ + H2O → W+ + Z-
Nel ponte salino ci sono due ioni (W+ e Z-), che sono spostati al catodo e all'anodo secondo:
Il) L'anodo riceve gli anioni (Z-) presente nel ponte salino per ossidazione dell'elemento (Y), che provoca un aumento della quantità di cationi (Y+) nella soluzione.
B) Il catodo riceve i cationi (W+) del ponte salino perché, durante il funzionamento a batteria, il catione (C+) presente nella soluzione si riduce a tabellone. Quindi, la soluzione catodica ha una maggiore quantità di anioni (N-) e quindi riceve il catione presente nel ponte salino.
Di Me. Diogo Lopes Dias
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
GIORNI, Diogo Lopes. "Ponte a vela"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. Consultato il 28 giugno 2021.


