Il chimico americano Gilbert N. Lewis (1875-1946) propose la regola dell'ottetto, che dice:
"Atomi di elementi diversi stabiliscono legami chimici, donando, ricevendo o condividendo elettroni, al fine di acquisire la configurazione elettronica di gas nobile, cioè con 8 elettroni nell'ultimo guscio (o con 2 elettroni nel caso di quegli atomi che hanno un solo guscio elettronico, come avviene con il idrogeno)."
Nel 1916, Lewis suggerì che per rimanere stabili, raggiungendo l'ottetto o il duetto, gli elementi che compongono il sostanze molecolari eseguire la condivisione di coppie di elettroni. Queste sostanze sono formate solo da atomi di idrogeno, non metalli e semimetalli, tutti con il tendenza a ricevere elettroni. Pertanto, non c'è modo per nessuno di loro di donare alcun elettrone (come avviene con i metalli nei legami ionici), ma tutti hanno bisogno di ricevere, quindi condividono i loro elettroni attraverso un legame covalente o molecolare.
Così, Gilbert Lewis propose un modo per rappresentare il legame covalente o molecolare, che divenne noto come
formula di Lewis. Si chiama anche formula elettronica o ancora, Formula elettronica di Lewis Lewis, perché la sua caratteristica principale è che mostra gli elettroni nel guscio di valenza di ciascun atomo e la formazione di coppie elettroniche.Ogni elettrone è rappresentato da un punto., che circonda il simbolo dell'elemento chimico corrispondente. Solo gli elettroni del guscio di valenza sono attorno all'elemento.
Come mostrato nella tabella sottostante, per conoscere la quantità di elettroni nel guscio di valenza, basta conoscere la famiglia delle Tavole Periodiche:

Nella formula di Lewis, ogni coppia di elettroni condivisa rappresenta un legame chimico (covalente), dove gli elettroni si incontrano nella regione dell'elettrosfera che è comune a ciascuna coppia di atomi che sono uniti tra loro. Pertanto, nella rappresentazione, sono affiancati.
Ad esempio, scopriamo qual è la formula di Lewis per l'idrogeno, la cui formula molecolare è: H2.
Ogni atomo di idrogeno ha un solo elettrone nel guscio di valenza, poiché questo elemento appartiene alla famiglia 1 della tavola periodica. Ciascuno ha bisogno di ricevere un elettrone in più, per essere stabile, con due elettroni nel guscio elettronico K. Quindi condividono i loro elettroni ed entrambi ne ottengono due. Guarda:
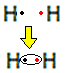
Questa è la formula di Lewis per la molecola del gas idrogeno.
L'ossigeno ha sei elettroni nel suo guscio elettronico, quindi ognuno ha bisogno di ricevere altri due elettroni per essere stabile, con otto elettroni. Pertanto, la formula di Lewis per la molecola del gas ossigeno è:

Vedi che ci sono due collegamenti, poiché ci sono due coppie condivise.
Vedi altri esempi di formule elettroniche di sostanze molecolari di seguito:
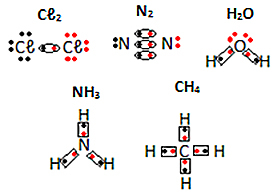
di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm
