sali inorganici sono formati dall'associazione ionica di almeno un catione (formato da qualsiasi metallo o ammonio) e un anione (semplice o composto).
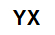
Formula molecolare generale di un sale
Quando aggiunti all'acqua, i sali si dissociano, rilasciando almeno un catione diverso dall'idronio (H+) e un anione diverso dall'idrossido (OH-).
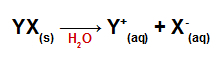
Equazione di dissociazione per qualsiasi sale
Classificazione dei sali
I sali, in generale, possono avere le seguenti classificazioni:
sale semplice: sale formato da un solo catione e un anione. Esempi: NaCl, CaSO4, KCN, NH4CO3 eccetera.
Sale idrogenato: ha due cationi (di cui uno deve essere l'idronio) e un anione. Esempi: NaHCO3, CaHBO3 eccetera.
Sale ossidrile: ha un catione e due anioni (uno dei quali deve essere l'idrossido). Esempi: MgOHCl, Al(OH)2ClO3 eccetera.
Sale idratato: presenta molecole d'acqua associate alla sua struttura cristallina. Esempi: CaCl2.2H2O, CuSO4.6H2L'ecc.
Sale doppio: ha due cationi (tutti diversi dall'idronio) e un anione oppure un catione e due anioni (tutti diversi dall'idrossido). Esempi: Tipo4CN, AgFeBO3 eccetera.
Allume: è il sale formato da due solfati con cationi NOx pari a +1 e +3, più 24 molecole di acqua. Esempi: Ag2SOLO4.Al2(SOLO4)3.24H2o, no2SOLO4.Sb2(SOLO4)3.24H2oh
Regola di denominazione del sale
Nome anione + de + nome catione
→ K3POLVERE4
Il sale ha l'anione fosfato (PO4-3) e il catione potassio (K+1), da qui il suo nome è fosfato di potassio.
→ Caso3
Il sale ha l'anione solfito (SO3-2) e il catione calcio (Ca+2), da qui il suo nome è solfito di calcio.
NOTA: Se il catione non è argento, zinco o un elemento che appartiene alle famiglie IA, IIA e IIIA, dobbiamo indicare il suo NOX con un numero romano davanti al nome del catione.
→ Cu2SOLO4
Il sale ha l'anione solfato (SO4-2) e il catione calcio (Cu+1), quindi il suo nome è solfato di rame I.
Sale idrogenato: Per questo sale, prima del nome dell'anione, bisogna scrivere il prefisso riferito alla quantità di idrogeno nella formula. Questo prefisso deve essere separato dalla parola idrogeno da un trattino.
→ NaHCO3
Il sale ha un idrogeno, un anione carbonato e un catione sodio, quindi il suo nome è carbonato monoidrogeno di sodio.
Sale ossidrile: Per questo sale, prima del nome dell'anione, bisogna scrivere il prefisso riferito alla quantità di ossidrili nella formula. Questo prefisso deve essere separato dalla parola idrossido da un trattino.
→ Al(OH)2ClO3
Il sale ha due ossidrili, l'anione clorato e il catione alluminio, quindi il suo nome è diidrossiclorato di alluminio.
Sale idratato: Per questo sale, dopo il nome del catione, bisogna scrivere il prefisso riferito alla quantità di molecole d'acqua nella formula. Questo prefisso deve essere separato dalla parola idratato da un trattino.
→ CaCl2.2H2oh
Il sale ha due molecole d'acqua, l'anione cloruro e il catione calcio, quindi il suo nome è cloruro di calcio diidrato.
Doppio sale con due cationi: Per questo sale bisogna scrivere la doppia parola tra parentesi dopo il nome dell'anione e poi il nome del catione più elettropositivo e l'altro catione.
→ AgFeBO3
Questo sale ha argento (catione più elettropositivo) e catione ferro II, oltre all'anione borato. Il suo nome è borato (doppio) d'argento e di ferro II.
-
Doppio sale con due anioni:
Nome dell'anione più elettronegativo + trattino + nome dell'anione meno elettronegativo + de + nome del catione
→ genere4CN
Questo sale contiene il catione titanio IV, oltre al fosfato (anione più elettronegativo) e all'anione cianuro. Il suo nome è cianuro di titanio fosfato IV.
Sale di allume: Per questo sale, ignoriamo la regola generale. Basta scrivere il termine allume seguito rispettivamente dal nome del catione di carica +3 e dal nome del catione di carica +1, separati dalla congiunzione e.
→ In2SOLO4.Sb2(SOLO4)3.24H2oh
Il sale di allume ha il catione antimonio +3 e il catione sodio +1, quindi il suo nome è allume antimonio III e sodio.
Caratteristiche fisiche dei sali
Sono solidi a temperatura ambiente;
Hanno alti punti di fusione e di ebollizione;
Sono formati da legami ionici;
Conducono una corrente elettrica allo stato liquido (dopo aver subito la fusione) o quando disciolti in acqua;
In genere sono solubili in acqua, ma ci sono sali che sono considerati praticamente insolubili.
Proprietà chimiche dei sali
I sali sono composti che hanno la capacità di reagire chimicamente (a condizione che non abbiano lo stesso catione o lo stesso anione di un'altra sostanza) con diversi gruppi di sostanze, vale a dire:
In una reazione di doppio scambio con un acido: formano un nuovo sale e un nuovo acido.
In una doppia reazione di scambio con una base: formano un nuovo sale e una nuova base.
In un doppia reazione di scambio con un altro sale: formare due nuovi sali.
Alcuni sali hanno la capacità di soffrire decomposizione quando sottoposto a calore, formando due o più nuove sostanze. Se riscaldiamo il bicarbonato di sodio (NaHCO3), ad esempio, si decomporrà formando carbonato di sodio (Na2CO3), acqua (H2O) e anidride carbonica (CO2).
Di Me. Diogo Lopes Dias
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-sao-sais-inorganicos.htm