diffusione ed effusione sono due leggi proposte dal chimico scozzese Thomas Graham, nel XIX secolo, sulla base dei suoi studi su miscele di gas e il comportamento di gas quando si attraversano le pareti di un contenitore.
Tra le osservazioni fatte da Thomas Graham sul comportamento dei gas in relazione alla diffusione e all'effusione, possiamo evidenziare quanto segue:
Un gas ha sempre la tendenza a passare attraverso piccoli fori presenti nella materia allo stato solido;
Più grande è massa molecolare molecule gas, maggiore è la sua difficoltà a passare attraverso i fori della materia solida;
Minore è la densità del gas, maggiore è la sua velocità di movimento;
Maggiore è la temperatura a cui è sottoposto un gas, maggiore è la velocità con cui si diffonde nell'ambiente o attraversa un orifizio;
- Un gas non rimane mai statico in un luogo particolare.
Diffusione
Diffusione è un fenomeno fisico che consiste nella capacità di un gas di diffondersi (cioè diffondersi) nello spazio di un'area o all'interno di un contenitore. Per questo possiamo dire che, all'interno di uno spazio, un gas non è mai confinato in un unico luogo.

Rappresentazione del verificarsi di una trasmissione
Inoltre, possiamo definire il diffusione ancora come la capacità che un gas ha di miscelarsi con un altro, quando posto nello stesso recipiente, formando una miscela gassosa omogenea.
Un esempio è quando i gas escono dagli scarichi dei veicoli. Per quanto tossici, non causano danni a breve termine all'uomo, poiché si diffondono nell'aria atmosferica, riducendo di conseguenza la loro concentrazione.
Versamento
Versamento è un fenomeno fisico che consiste nel passaggio di un gas attraverso fori esistenti nelle pareti di un determinato contenitore, cioè consiste nell'uscita di un gas da un ambiente all'altro.

Rappresentazione del verificarsi di un'effusione
Un esempio è quando i palloncini vengono gonfiati per una festa e, il giorno dopo, vengono tutti sgonfiati, tutto a causa dell'aria che fuoriesce dai fori contenuti nei palloncini.
Calcoli relativi a diffusione ed effusione
Possiamo calcolare, secondo le equazioni proposte da Graham, la velocità alla quale si comporta un gas diffusione o effusione. Secondo Graham, le velocità di diffusione e di effusione di due gas miscelati in un contenitore sono sempre inversamente proporzionale al quadrato delle loro densità relative o delle loro masse molari.
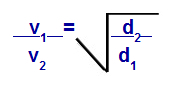
Legge di Graham per quanto riguarda la densità
v1 = velocità (effusione o diffusione) del gas 1 nella miscela;
v2 = velocità (effusione o diffusione) del gas 2 nella miscela;
d1 = densità del gas 1 della miscela;
d2 = densità del gas 2 della miscela;
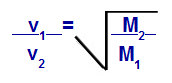
Legge di Graham sulla massa molare
v1 = velocità (effusione o diffusione) del gas 1 nella miscela;
v2 = velocità (effusione o diffusione) del gas 2 nella miscela;
M1 = massa molare del gas 1 della miscela;
M2 = massa molare del gas 2 nella miscela.
Di Me. Diogo Lopes Dias
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm

