Uno reazione reversibile si verifica quando è possibile ritrasformare i prodotti in reagenti. Questo tipo di reazione entra in equilibrio chimico quando la velocità di sviluppo della reazione diretta, cioè la reazione con consumo di reagenti e formazione di prodotti avviene alla stessa velocità della reazione inversa - formazione di reagenti e consumo di prodotti.
Questi tipi di reazioni equilibrate si vedono molto nella vita di tutti i giorni. Un esempio è ciò che accade nelle grotte, nella formazione delle cosiddette stalattiti e stalagmiti.
Le acque sotterranee sono soggette a pressioni elevate, quindi contengono grandi quantità di anidride carbonica (CO2(g)) disciolto in esso. Quando si attraversano suoli che contengono calcare (CaCO3(i)), questo carbonato si dissolve e si formano delle grotte, secondo la reazione seguente:
CaCO3(i) + CO2(g) + H2oh(1) → Ca2+(Qui) + 2 HCO-3(ac)
Tuttavia, gli ioni carbonato e calcio possono reagire, ri-precipitando come carbonato di calcio. Lo dimostra la reazione:
Qui2+(Qui) + 2 HCO-3(ac)→ CaCO3(i) + CO2(g) + H2oh(1)
Come avrai notato, una reazione è esattamente l'opposto dell'altra: i reagenti diventano prodotti e i prodotti diventano reagenti. Quindi, possiamo rappresentare questa reazione in equilibrio come segue:
CaCO3(i) + CO2(ac) + H2oh(1) Qui2+(Qui) + 2 HCO-3(ac)
Qui2+(Qui) + 2 HCO-3(ac)
La lenta e continua cessione di carbonato dalle gocce mineralizzate dal tetto delle grotte cola, la loro acqua evapora e si ha rilascio di CO2. Quindi l'equilibrio chimico è spostato nella direzione opposta (di formazione dei reagenti), quindi il CaCO3(i) si forma, cioè il stalattiti sul tetto delle grotte. La goccia, cadendo, ha ancora sciolto il carbonato, che si deposita sul fondo della grotta, formando il forming stalagmiti.
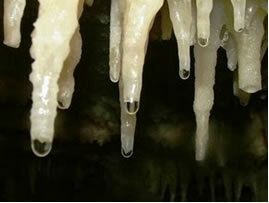
Acqua con colatura di calcare per la formazione di stalattiti e stalagmiti
di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/equilibrio-quimico-nas-cavernas.htm
