Tra le complessità dello studio atomico c'è la determinazione della dimensione dell'atomo o, meglio, della raggio atomico. Questa proprietà periodica descrive la distanza dal nucleo all'elettrone più esterno dei suoi livelli elettronici. Per determinarlo, viene eseguita una media aritmetica della distanza tra i nuclei di due atomi che formano una sostanza semplice, ad esempio.
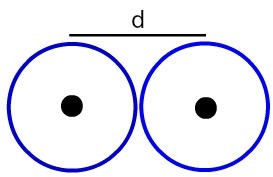
Rappresentazione della distanza tra due nuclei atomici
Determiniamo il raggio atomico (RA) degli atomi esemplificati nell'immagine. Per fare ciò, basta dividere la distanza tra i nuclei per 2:
RA = d
2
oh studio dei raggi atomici è importante perché favorisce la comprensione di alcuni eventi fisici (densità, punto di fusione, punto di ebollizione ed energia di ionizzazione) e sostanze chimiche (legami chimici) che si verificano con atomi.
Analizzando una tavola periodica, possiamo valutare se un atomo è più grande o più piccolo rispetto ad un altro, e quindi determinare se ha maggiore o minore facilità nell'avere uno o più elettroni rimossi dai loro orbitali. IL
valutazione e determinazione del raggio atomico nella tavola periodica viene eseguita secondo due criteri fondamentali:a) Numero di livelli energetici (famiglie o gruppi/colonne verticali)
Sappiamo che gli atomi possono avere fino a sette livelli energetici (K, L, M, N, O, P, Q) e che ciascuno elemento chimico si trova in famiglie o gruppi (colonne verticali) e in periodi (colonne orizzontale). I periodi indicano il numero di livelli dell'elemento atomo e la famiglia indica il sottolivello più energetico dell'atomo. In un gruppo o in una famiglia, gli elementi chimici differiscono per la quantità di livelli di energia. Vedi la tabella qui sotto:

Maggiore è il numero di livelli energetici di un atomo, maggiore è il suo raggio atomico. Analizzando la tabella sopra, si può notare che il francio ha l'atomo più grande perché ha sette livelli. L'atomo di potassio, d'altra parte, ha un raggio più piccolo in quanto ha quattro livelli di energia. La seguente è una rappresentazione comparativa tra l'atomo di francio e l'atomo di potassio:
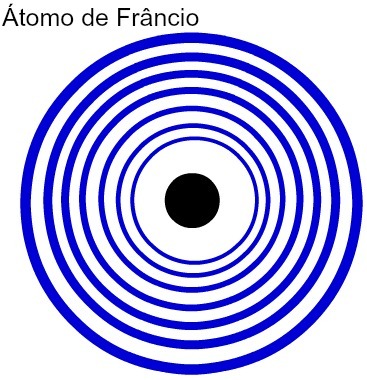
Rappresentazione dei sette livelli energetici dell'atomo di Francio

Rappresentazione dei quattro livelli energetici dell'atomo di Potassio
Il diagramma seguente rappresenta come l'aumento del raggio atomico avviene nella stessa famiglia o gruppo (colonne verticali) della tavola periodica. Maggiore è il numero di livelli, maggiore è il raggio, cioè sulla tavola periodica, il raggio atomico cresce dall'alto verso il basso:
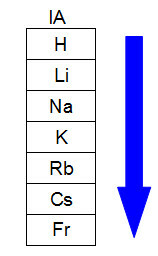
Rappresentazione di come aumenta il raggio atomico in una famiglia di tavole periodiche
b) Numero atomico (Z o numero di protoni) nello stesso periodo (colonna orizzontale)
Quando gli elementi chimici appartengono allo stesso periodo, i loro atomi hanno la stessa quantità di livelli di energia, ma la quantità di protoni all'interno dei loro nuclei è diversa. Quella che segue è una sequenza di elementi appartenenti al quarto periodo della tavola periodica:
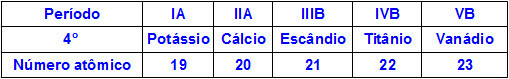
Tutti gli atomi degli elementi rappresentati nella tabella sopra hanno quattro livelli di energia, ma ognuno di essi ha una diversa quantità di protoni nei propri nuclei. Poiché i protoni all'interno del nucleo esercitano una forza attrattiva sugli elettroni presenti nei livelli energetici, maggiore è la quantità di protoni nel nucleo, maggiore è la loro attrazione verso gli elettroni. Il risultato è un'approssimazione dei livelli verso il nucleo, diminuendo la dimensione dell'atomo.
↑Z = Raggio atomico
↓Z = Raggio atomico
Quindi, possiamo affermare che il raggio atomico dell'elemento potassio è maggiore di quello del vanadio a causa del minor numero di protoni.
Il diagramma seguente rappresenta come l'aumento del raggio atomico avviene nello stesso periodo (linea orizzontale). Più piccolo è il numero atomico, maggiore è il raggio, ovvero il raggio atomico nella tabella cresce da destra a sinistra
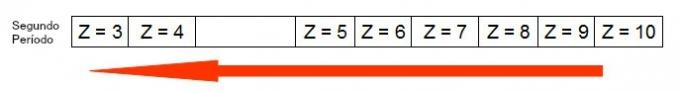
Rappresentazione di come il raggio atomico aumenta in un periodo della tavola periodica
Di Me. Diogo Lopes Dia
