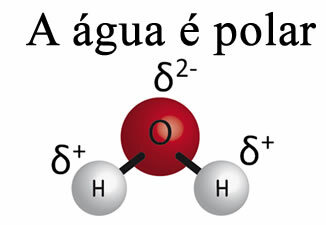
L'acqua da sola non può rimuovere il grasso dai materiali. Questo è perché Ill'acqua è polare, come mostrato nell'immagine sottostante, a causa della differenza di elettronegatività che esiste tra gli atomi di idrogeno e di ossigeno delle loro molecole. D'altro canto, il grasso non è polare e quindi l'acqua non scioglie i grassi.
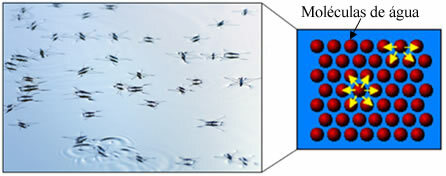
Inoltre, l'acqua ha qualcosa chiamato tensione superficiale. Puoi capirlo meglio nel testo. Tensione superficiale dell'acqua, ma fondamentalmente è una sorta di film o membrana elastica che si forma sulla superficie dell'acqua, che le impedisce di penetrare nei tessuti e in altri materiali per rimuovere lo sporco. Le molecole d'acqua si attraggono in tutte le direzioni attraverso legami di idrogeno, ma le molecole di superficie interagiscono solo con le molecole sul lato e sotto, creando una differenza in forze di coesione, che provoca la contrazione delle molecole superficiali e la formazione di questa tensione superficiale.
Ecco che entrano in gioco saponi e detersivi (dal latino
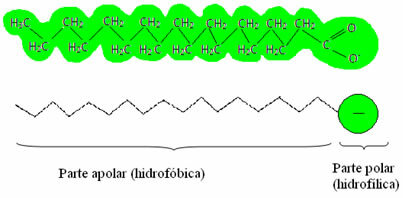
disintossicare = chiaro), che sono anche chiamati agenti tensioattivi, in quanto hanno la capacità di ridurre la tensione superficiale dell'acqua e, inoltre, interagiscono sia con l'acqua che con il grasso. Come avviene?Saponi e detersivi hanno sali di acidi grassi, che sono lunghe molecole formate da a by parte non polare (cosa è idrofobico – idro = acqua; fobe = avversione) e a estremità polare (idrofilo – idro = acqua; phyla = amico). Di seguito abbiamo una struttura tipica di un sapone:
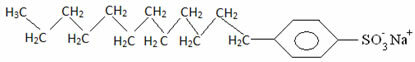
Generalmente i detergenti sono sali di acidi solfonici a catena lunga:
Pertanto, la parte non polare di queste molecole presenti nei saponi e detersivi interagisce con il grasso, mentre l'estremità polare interagisce con l'acqua, raggruppandosi in piccoli globuli, chiamato da micelle, in cui le parti idrofile sono rivolte verso l'esterno della micella a contatto con le molecole d'acqua, e la il grasso rimane all'interno, a contatto con la parte non polare o idrofoba, processo simile a quello mostrato nell'immagine a Seguire:
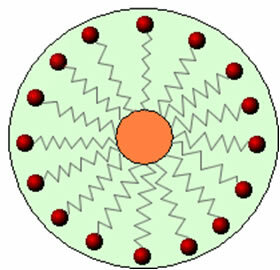
In questo modo lo sporco grasso viene intrappolato al centro delle micelle e può essere rimosso. Un altro punto è che detersivi e saponi hanno la capacità di abbassare la tensione superficiale dell'acqua, perché diminuire le interazioni tra le sue molecole, facilitando così la penetrazione di vari materiali per rimuovere il sporco.
di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/quimica-dos-saboes-detergentes.htm
