IL lieve ossidazione negli alcheni è una reazione organica eseguita quando un dato alchene viene posto in un mezzo formato da una base con acqua e sale di permanganato di potassio (KMnO4), sale che comunemente viene chiamato Reagente di Bayer.
Il prodotto formato si chiama is alcol vicinale, cioè alcoli che hanno due gruppi ossidrile (OH-) posizionato su carboni vicini, come nella seguente formula generale:
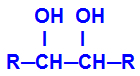
NOTA: R può essere un radicale o atomi di idrogeno.
Reagente Bayer
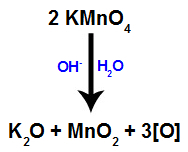
Quando il Reagente di Bayer (KMnO4) viene miscelato con acqua in presenza di base inorganica (OH-), reagisce e forma ossido di potassio (K2O), biossido di manganese (MnO2) e ossigeni nascenti (ossigeno libero, rappresentato da [O]). Vedere l'equazione bilanciata del processo.

Questi ossigeni nascenti formati dal reagente di Bayer sono responsabili della lieve reazione di ossidazione negli alcheni (come vedremo nei punti seguenti).
Meccanismi di una lieve reazione di ossidazione negli alcheni
1° meccanismo: formazione di ossigeni nascenti dal reagente di Bayer;
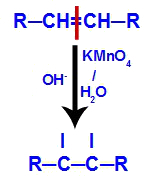
2° meccanismo: Attacco degli ossigeni nascenti al doppio legame presente nell'alchene, provocando la rottura del legame pi e conseguente formazione di una valenza libera in ciascuno degli atomi di carbonio coinvolti con il pi link.
3° meccanismo: Gli ossigeni nascenti si uniscono agli idroni (H+) formato dall'autoionizzazione dell'acqua, dando origine a gruppi ossidrile (OH-).
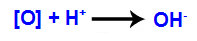
4° meccanismo: Connessione degli ossidrili formati in ciascuna delle valenze libere situate sui carboni dove si trovava il legame pi, originando un dialcool vicinale.

Esempi di reazioni di ossidazione lieve negli alcheni
→ Lieve reazione di ossidazione su but-2-ene
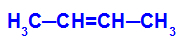
Formula di struttura del but-2-ene
Inizialmente, il doppio legame tra i carboni 2 e 3 dell'alchene viene rotto dall'attacco degli ossigeni nascenti, creando una valenza libera (traccia verticale) sui carboni 2 e 3.

Rompere il legame pi tra i carboni 2 e 3 nel but-2-ene
Quindi, l'ossigeno nascente si unisce con un idronio (H+) dalla ionizzazione dell'acqua, formando gruppi ossidrile (OH-), che si legano alle valenze libere dei carboni 2 e 3, dando luogo a un dialcool vicinale.
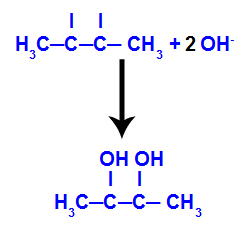
Alcool di prossimità formato da but-2-ene
→ Lieve reazione di ossidazione su 2-metil-propene
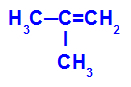
Formula di struttura del 2-metil-propene
Inizialmente, il doppio legame tra i carboni 1 e 2 dell'alchene viene rotto dall'attacco degli ossigeni nascenti, creando una valenza libera (traccia verticale) sui carboni 1 e 2.
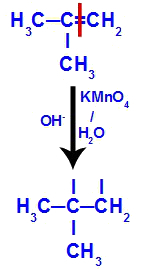
Rompere il legame pi tra i carboni 1 e 2 in 2-metil-propene
Quindi, l'ossigeno nascente si unisce con un idronio (H+) dalla ionizzazione dell'acqua, formando gruppi ossidrile (OH-), che si legano alle valenze libere dei atomi di carbonio 1 e 2, dando luogo a un dialcool vicinale.
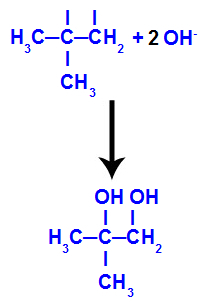
Alcool di prossimità formato da 2-metil-propene
Di Me. Diogo Lopes Dias
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/oxidacao-branda-alcenos.htm
