Le reazioni reversibili di solito iniziano con una certa quantità di reagenti. All'inizio della reazione diretta, nel tempo, questi reagenti vengono consumati per la formazione dei prodotti, di conseguenza la concentrazione dei reagenti diminuisce mentre la concentrazione dei prodotti aumenta. Quindi, inizia anche la reazione inversa, producendo anche i reagenti, fino a quando la velocità di sviluppo (velocità) delle reazioni diretta e inversa rimane la stessa, raggiungendo il cosiddetto equilibrio chimico.
In equilibrio esiste la costante di equilibrio Kc, che è sostanzialmente espressa da:
|
Kc = [prodotti]coefficiente nell'equazione chimica bilanciata [reagenti]coefficiente nell'equazione chimica bilanciata |
Cioè, considerando la seguente generica reazione di equilibrio:
a A + b B ↔ c C + d D
Poiché le lettere minuscole sono i coefficienti e le lettere maiuscole sono le sostanze, la costante di equilibrio di questa reazione sarà:
Kc = [Ç]ç. [D]d
[IL]Il. [B]B
Maggiori dettagli su questo possono essere visti nel testo Kc e Kp costanti di equilibrio. Questo testo ci mostra anche qualcosa di importante: che i valori di Kc possono mostrarci se la concentrazione dei reagenti e la prodotti sono uguali o se uno è maggiore dell'altro e, di conseguenza, se l'equilibrio chimico viene spostato in qualche direzione del reazione.
Quindi dobbiamo determinare il valore di Kc. Per fare ciò, tieni presente che questi calcoli sono sperimentali, quindi diamo un'occhiata ad alcuni esempi di reazioni e ai dati ottenuti da esse.
Qualcosa che è molto utile per eseguire questi calcoli è scrivere una tabella simile a quella mostrata di seguito e seguire i passaggi menzionati in essa:

Tabella per organizzare i dati utilizzati per calcolare la costante di equilibrio
Ora passiamo alla pratica:
Esempio 1: In un recipiente chiuso, della capacità di 2 L, alla temperatura di 100°C, si trovano 20 moli di N2oh4. Inizia la seguente reazione reversibile: N2oh4 NO2. Dopo qualche tempo, si trovò che la reazione raggiunse l'equilibrio chimico e che 8 moli di NO2 si era formato. Qual è il valore della costante di equilibrio Kc alla temperatura di 100°C?
Risoluzione:
Usiamo la tabella:

Tabella utilizzata per risolvere l'esempio di calcolo della costante di equilibrio
Si noti che nella riga dove sono state scritte le quantità che reagiscono e si formano, sappiamo che sono state spese 4 moli di N2oh4, perché il rapporto è 1: 2 e si sono formate 8 moli di NO2.
Ora basta sostituire i valori trovati nell'espressione della costante di equilibrio Kc di questa reazione:
Kc = [AL2]2
[N2oh4]
Kc = (4 mol/l) 2
(8 mol/l)
Kc = 2 mol/L
Il valore di Kc è adimensionale, non ha unità relative a nessuna grandezza.
Ora, diamo un'occhiata a un esempio, che contiene anche prodotti dall'inizio:
Esempio 2: In un recipiente chiuso, della capacità di 5 L, alla temperatura T, si trovano 2 moli di idrogeno gassoso, 3 moli di iodio gassoso e 4 moli di acido iodidrico. La reazione entra in equilibrio chimico, alla temperatura T, e si scopre che nel recipiente c'è 1 mole di gas idrogeno. Qual è il grafico che rappresenta questo equilibrio e qual è il valore della costante di equilibrio Kc alla temperatura di T?
Risoluzione:
Usando la tabella:
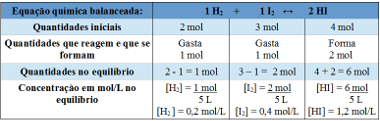
Tabella utilizzata per determinare la costante di equilibrio
Il grafico che mostra le variazioni nelle concentrazioni mol/L di reagenti e prodotti fino al raggiungimento dell'equilibrio può essere dato da:

Grafico dell'equilibrio chimico che mostra i cambiamenti nelle concentrazioni di reagenti e prodotti
Ora scopriamo il valore della costante di equilibrio:
Kc =__[HI]2__
[H2 ]. [IO2]
Kc = (1,2)2
0,2. 0,4
Kc = 18
di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/calculo-constante-equilibrio-kc.htm
