Al famiglie della tavola periodica sono le sequenze verticali del tavolo e si raccolgono elementi chimici con proprietà chimiche simili. Tali somiglianze sono dovute alla presenza di uguali quantità di elettroni di valenza per gli elementi raggruppati nella stessa famiglia. Le famiglie accolgono gli elementi rappresentativi nei gruppi 1 e 2, da 13 a 18 e gli elementi di transizione nei gruppi da 1 a 12.
Leggi anche:Elementi transuranici: gli elementi chimici artificiali che vengono dopo l'uranio nella tavola periodica
Argomenti di questo articolo
- 1 - Riepilogo delle famiglie della tavola periodica
- 2 - Organizzazione delle famiglie della tavola periodica
-
3 - Nomenclatura delle famiglie della tavola periodica
- → Elementi rappresentativi della tavola periodica
- → Elementi di transizione della tavola periodica
- 4 - Elementi chimici delle famiglie della tavola periodica
-
5 - Principali caratteristiche delle famiglie della tavola periodica
- → Gruppo 1 o famiglia di metalli alcalini
- → Gruppo 2 o famiglia dei metalli alcalino terrosi
- → Gruppi da 3 a 12 o famiglia di metalli di transizione
- → Gruppo 13 o famiglia del boro
- → Gruppo 14 o famiglia del carbonio
- → Gruppo 15 o famiglia dell'azoto
- → Gruppo 16 o famiglia dell'ossigeno (calcogeni)
- → Gruppo 17 o famiglia di alogeni
- → Gruppo 18 o famiglia di gas nobili
-
6 - Tavola periodica e distribuzione elettronica
- → Distribuzione elettronica di elementi rappresentativi
- → Distribuzione elettronica degli elementi di transizione
- 7 - Esercizi risolti sulle famiglie della Tavola Periodica
Riassunto delle famiglie della tavola periodica
Le famiglie corrispondono alle linee verticali del Tavola periodica.
Conosciute anche come gruppi, le famiglie nella tavola periodica sono numerate da 1 a 18.
Gli elementi chimici della stessa famiglia hanno proprietà chimiche simili.
La familiarità di un insieme di elementi è spiegata dall'avere un numero uguale di elettroni di valenza.
Gli elementi rappresentativi sono divisi nei gruppi 1, 2, 13, 14, 15, 16, 17 e 18. Ognuna di queste famiglie ha nomi specifici.
Gli elementi di transizione formano un'unica famiglia che si suddivide nei gruppi 3, 4, 5, 6, 7, 8, 9, 10, 11 e 12.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Organizzazione delle famiglie della tavola periodica
Le famiglie nella tavola periodica sono le sequenze verticali della tavola, ovvero le colonne. Conosciuti anche come gruppi, le famiglie della tavola periodica sono numerati da 1 a 18, da sinistra a destra.
Gli elementi chimici che occupano la stessa colonna sono considerati appartenenti alla stessa famiglia., a causa della somiglianza tra le loro proprietà chimiche, dovuta al fatto che hanno lo stesso numero di elettroni A guscio di valenza. Ad esempio, tutti gli elementi chimici della famiglia 18 hanno otto elettroni nel guscio di valenza (guscio completo) e raramente partecipano legami chimici.
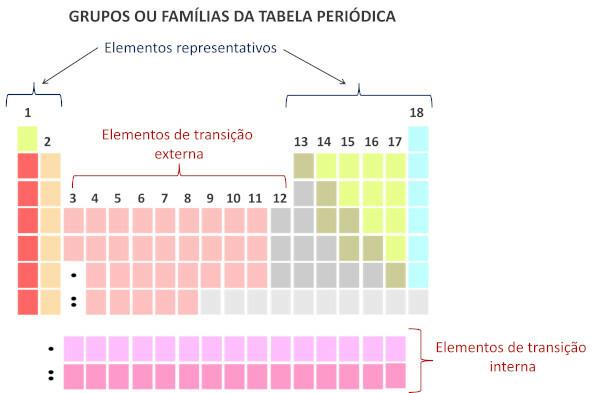
Secondo il moderno sistema di Unione Internazionale di chimica pura e applicata (Iupac), ogni gruppo o famiglia è identificato da un numero da 1 a 18, partendo da sinistra verso destra nella Tavola Periodica.
È importante sottolineare che il vecchio sistema IUPAC adottava un sistema alfanumerico, con le lettere A e B per riferirsi rispettivamente agli elementi rappresentativi e di transizione. Attualmente, questo tipo di nomenclatura non è più utilizzato.
Nomenclatura delle famiglie della tavola periodica
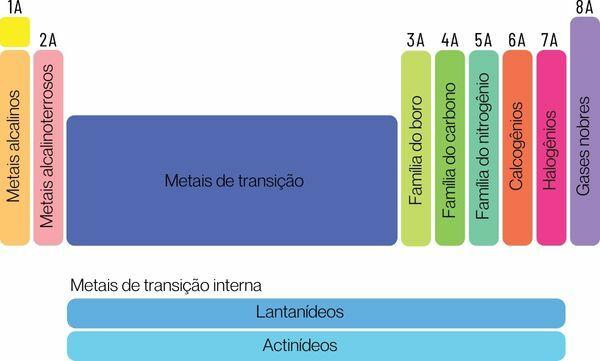
Gli elementi chimici possono essere classificati in due grandi famiglie: elementi rappresentativi ed elementi di transizione.
→ Elementi rappresentativi della tavola periodica
Gli elementi rappresentativi sono divisi nei gruppi 1, 2, 13, 14, 15, 16, 17 e 18. Ciascuno di questi gruppi ha un nome specifico, con il quale può anche essere conosciuto. Aspetto:
Gruppo 1: famiglia di metalli alcalino.
Gruppo 2: famiglia di metalli alcalino terrosi.
Gruppo 13: boro o famiglia di metalli terrestri.
Gruppo 14: famiglia del carbonio.
Gruppo 15: Famiglia dell'azoto o dei pnicogeni.
Gruppo 16: famiglia dell'ossigeno o del calcogeno.
Gruppo 17: famiglia di alogeni.
Gruppo 18: famiglia di gas nobili.
→ Elementi di transizione della tavola periodica
Voi elementi di transizioneformare un'unica famiglia divisa in gruppi 3, 4, 5, 6, 7, 8, 9, 10, 11 e 12. Anche le serie dei lantanidi e degli attinidi fanno parte degli elementi di transizione.
Gli elementi di transizione sono tutti metallici e hanno proprietà chimiche simili, pur avendo elettroni diversi nel guscio di valenza e, quindi, formerebbero un'unica e grande famiglia di metalli di transizione.
Elementi chimici delle famiglie della tavola periodica
Ogni famiglia o gruppo è composto da un insieme di elementi chimici. Vedi la descrizione degli elementi chimici che compongono ogni famiglia:
Gruppo 1:litio, sodio, potassio, rubidio, cesio, francio.
Gruppo 2:berillio, magnesio, calcio, stronzio, bario, Radio.
Gruppo 3:scandio, ittrio, serie dei lantanidi e serie degli attinidi.
Gruppo 4: titanio, zirconiaO, afnio È rutherfordio.
Gruppo 5:vanadio, niobio, tantalio È dubnio.
Gruppo 6:cromo, molibdeno, tungsteno È seaborgio.
Gruppo 7:manganese, tecnezio, renio È bohrio.
Gruppo 8: ferro, rutenio, osmio È hassio.
Gruppo 9:cobalto, rodio, iridio e meitnerio.
Gruppo 10:nichel, palladio, platino e darmstadtio.
Gruppo 11: rame, argento, oro e roentgenio.
Gruppo 12:zinco, cadmio, Mercurio e Copernico.
Gruppo 13: boro, alluminio, gallio, indio e tallio.
Gruppo 14: carbonio, silicio, germanio, lattina, Guida e flerovio.
Gruppo 15:azoto, fosforo, arsenico, antimonio È bismuto.
Gruppo 16:ossigeno, zolfo, selenio, tellurio, polonio e livermorio.
Gruppo 17: fluoro, cloro, bromo, iodio e astato.
Gruppo 18:elio, neon, argon, krypton, xeno È radon.
Importante: l'elemento chimico idrogeno è un caso particolare, perché pur trovandosi accanto al gruppo 1, non fa parte della famiglia dei metalli alcalini, in quanto non condivide proprietà chimiche simili.
Saperne di più: Quali sono gli elementi radioattivi nella tavola periodica?
Principali caratteristiche delle famiglie della Tavola Periodica
Sono solidi metallici, lucidi e lisci.
Hanno un'elevata conducibilità termica e alta Conducibilità elettrica.
Avere temperature punto di fusione relativamente basso.
Sono molto reattivi con acqua.
Tendenza a formare cationi monovalenti (carica +1).
Sono solidi metallici, lucidi e più duri rispetto ai metalli alcalini.
Si ossidano facilmente.
Hanno un'elevata conduttività termica e un'elevata conduttività elettrica.
Hanno temperature di fusione leggermente più elevate rispetto ai metalli alcalini.
Sono reattivi con l'acqua.
Tendenza a formare cationi bivalenti (carica +2).
Sono la famiglia più numerosa della tavola periodica.
Solidi metallici duri e lucenti.
Hanno un'elevata conduttività termica e un'elevata conducibilità elettrica.
Denso.
Elevate temperature di fusione.
possono presentare diversi stati di ossidazione.
→ Gruppo 13 o famiglia del boro
Hanno proprietà intermedie tra le proprietà dei metalli e non metalli.
Sono solidi in condizioni ambientali.
Tendenza a formare cationi trivalenti (carica +3).
→ Gruppo 14 o famiglia del carbonio
Hanno proprietà intermedie tra le proprietà dei metalli e dei non metalli.
Sono solidi in condizioni ambientali.
Tendenza a formare quattro legami.
Sono solidi in condizioni ambientali.
Carbonio e silicio possono formare legami a catena.
→ Gruppo 15 o famiglia dell'azoto
Hanno proprietà intermedie tra le proprietà dei metalli e dei non metalli.
Solidi in condizioni ambientali, ad eccezione dell'azoto, che è un gas.
L'azoto e il fosforo sono fondamentali negli organismi viventi.
L'arsenico è altamente tossico.
→ Gruppo 16 o famiglia dell'ossigeno (calcogeni)
Hanno proprietà diverse, cambiando da elemento non metallico a elemento metallico man mano che si scende nella famiglia.
Solidi in condizioni ambientali, ad eccezione dell'ossigeno, che è un gas.
Tendenza a formare anioni bivalenti (carica -2).
→ Gruppo 17 o famiglia di alogeni
Sono non metalli.
Abbastanza reattivo.
Cattivi conduttori termici ed elettrici.
In condizioni ambientali, il fluoro e il cloro esistono come gas, il bromo è liquido e lo iodio è solido.
Tendenza a formare anioni monovalenti (carica -1).
→ Gruppo 18 o famiglia di gas nobili
Sono non metalli.
Molto poco reattivi, quindi possono essere chiamati gas inerti.
Esistono sotto forma di gas.
Non hanno tendenza a formarsi ioni.
Tavola periodica e distribuzione elettronica
Gli elementi chimici appartenenti alla stessa famiglia o gruppo hanno proprietà chimiche simili perché hanno uguale numero di elettroni nel guscio di valenza.
Il numero di elettroni nel guscio di valenza è rilevante, in quanto determina la tendenza alla formazione di cationi o anioni, il tipo di legame chimico da formare, l'energia coinvolta nelle reazioni chimiche, tra gli altri caratteristiche. Per trovare il numero di elettroni di valenza, è necessario conoscere il numero atomico dell'elemento ed esegui il tuo distribuzione elettronica.
→ Distribuzione elettronica di elementi rappresentativi
Gli elementi rappresentativi hanno i loro elettroni più energetici nei sottolivelli S È P dello strato elettronico (n). La seguente tabella raccoglie le configurazioni elettroniche associate a ciascuna famiglia di elementi rappresentativi. il termine N varia da 1 a 7 e rappresenta il livello energetico occupato dagli elettroni di valenza, equivalente al periodo (linea orizzontale) della tavola periodica in cui si trova l'elemento.
Distribuzione elettronica di elementi rappresentativi | ||
famiglia o gruppo |
Distribuzione elettronica |
Esempio |
1 |
noi1 |
Li (Z=3): 1s2 2s1 |
2 |
noi2 |
Be (Z=4): 1s2 2s2 |
13 |
noi2 np1 |
B (Z=5): 1s2 2s22p1 |
14 |
noi2 np2 |
DO (Z=6): 1s2 2s22p2 |
15 |
noi2 np3 |
N (Z=7): 1s2 2s22p3 |
16 |
noi2 np4 |
O (Z=8): 1s2 2s22p4 |
17 |
noi2 np5 |
FA (Z=9): 1s2 2s22p5 |
18 |
noi2 np6 |
Ne (Z=10): 1s2 2s22p6 |
→ Distribuzione elettronica degli elementi di transizione
Gli elementi di transizione sono distribuiti tra i gruppi 3 e 12 e avere i sottolivelli D È F occupato da elettroni di valenza:
Elementi di transizione esterni: mantenere gli elettroni di valenza nel sottolivello D, mantenendo la configurazione elettronica uguale a noi2 (n-1) d(da 1 a 8). Ad esempio, l'elemento nichel (Z = 28) appartiene al gruppo 10 e la sua configurazione è 1s2 2s2 2p6 3s2 3p6 4s2 3d8.
Elementi di transizione interni: fanno parte del gruppo 3, ma sono “interni” alla Tavola Periodica, essendosi espansi al di sotto di essa, nei periodi 6 (lantanidi) e 7 (attinidi). Questi elementi hanno elettroni di valenza che occupano il subshell F e configurazione elettronica generale di noi2 (n-2) f(da 1 a 13). Ad esempio, l'elemento lantanio (Z = 57) è il primo elemento della serie dei lantanidi e la sua configurazione elettronica è 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 17:006 6s2 4f1.
Sapere anche:Qual è l'origine della tavola periodica?
Esercizi risolti sulle famiglie della Tavola Periodica
domanda 1
(UFC - adattato) Per quanto riguarda la moderna classificazione periodica degli elementi, spuntare la dichiarazione vera:
A) Nella tavola periodica, le famiglie oi gruppi corrispondono a linee orizzontali.
B) Gli elementi di una famiglia hanno proprietà chimiche molto diverse.
C) In una famiglia, gli elementi hanno generalmente lo stesso numero di elettroni nell'ultimo guscio.
D) In un periodo, gli elementi hanno proprietà chimiche simili.
E) Gli elementi rappresentativi sono distribuiti nei gruppi da 3 a 12.
Risoluzione:
Alternativa C
L'elemento A non è corretto: le famiglie oi gruppi sono le colonne (linee verticali) della tavola periodica.
Elementi B e D errati: in una famiglia, gli elementi hanno proprietà chimiche simili. Nei periodi, gli elementi hanno lo stesso guscio elettronico occupato dagli elettroni di valenza.
Elemento C corretto: in una famiglia, gli elementi hanno lo stesso numero di elettroni nell'ultimo guscio.
Articolo E errato: gli elementi rappresentativi sono i gruppi 1, 2, 13, 14, 15, 16, 17 e 18. Gli elementi di transizione sono distribuiti nei gruppi da 3 a 12.
Domanda 2
(EAM) Gli elementi A, B e C hanno le seguenti configurazioni elettroniche nei loro gusci di valenza:
R: 3s1
B: 4s2 4p4
C: 3s2
Sulla base di queste informazioni, selezionare l'opzione corretta.
A) L'elemento A è un metallo alcalino.
B) L'elemento B è un alogeno.
C) L'elemento C è un calcogeno.
D) Gli elementi A e B appartengono al terzo periodo della tavola periodica.
E) I tre elementi appartengono allo stesso gruppo della tavola periodica.
Risoluzione:
Alternativa A
Item A corretto: l'elemento A ha una distribuzione elettronica contenente un solo elettrone di valenza, quindi appartiene al gruppo 1 della tavola periodica.
Elemento B errato: l'elemento B ha una configurazione elettronica 4s2 4p4, indicando che ci sono 6 elettroni nell'ultimo guscio e che questo elemento appartiene al gruppo 16 (calcogeni).
Elemento C errato: l'elemento C ha una configurazione elettronica con 2 elettroni nell'ultimo guscio, quindi è un elemento del gruppo 2 nella tabella.
Elemento D errato: l'elemento A appartiene al terzo periodo (n = 3) e l'elemento B appartiene al quarto periodo (n = 4).
Punto E errato: i tre elementi hanno quantità diverse di elettroni nell'ultimo guscio, quindi non possono far parte della stessa famiglia.
Di Ana Luiza Lorenzen Lima
Insegnante di chimica
Clicca qui, scopri cos'è uno strato di valenza e scopri come può essere identificato.
Comprendi come viene eseguita la distribuzione elettronica e dai un'occhiata agli esempi.
Conoscere le particolarità degli elementi di transizione interni (attinidi e lantanidi), che occupano il sesto e il settimo periodo del gruppo 3 della Tavola Periodica.
Conoscere gli elementi chimici esistenti, capire cosa sono e come rappresentarli.
I gas nobili sono gli unici elementi presenti in natura in forma isolata. Scopri di più su di loro qui in questo articolo!
Scopri gli alogeni, le loro proprietà, caratteristiche e i loro principali usi nella vita di tutti i giorni.
Scopri di più sui metalli alcalino terrosi, conoscendo caratteristiche, proprietà e applicazioni.
Comprendi cos'è il numero atomico e impara quali sono le caratteristiche dell'atomo che possono essere determinate da esso.
Controlla qui cos'è la tavola periodica e guarda un modello interattivo per farti conoscere tutti gli elementi chimici che la costituiscono.

