Al funzioni dell'azoto sono un gruppo di composti organici che hanno atomi di azoto attaccato alla catena di carbonio. Si distinguono per i rispettivi gruppi funzionali, che sono insiemi di atomi collegati in una certa configurazione e che definiscono le proprietà caratteristiche di ciascuna funzione.
Le funzioni dell'azoto sono:
ammine;
ammidi;
composti nitro;
nitrili;
isonitrili.
Leggi anche:Quali sono le funzioni dell'ossigeno?
Riassunto delle funzioni dell'azoto
Le funzioni dell'azoto sono composti organici che contengono atomi di azoto.
Ammine, ammidi, nitrocomposti, nitrili e isonitrili sono le funzioni dell'azoto.
Le funzioni inorganiche si distinguono per il loro gruppo funzionale.
Le ammine derivano dalla sostituzione di idrogeni di ammoniaca da radicali alchilici.
Le ammidi hanno lo stesso atomo di carbonio unito ad azoto e carbonio. ossigeno.
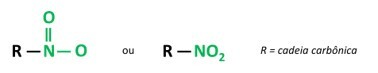
I composti nitro contengono il gruppo -NO.2.
I nitrili sono caratterizzati dalla presenza di un triplo legame tra carbonio e azoto.
Gli isonitrili hanno un triplo legame tra azoto e carbonio, con azoto attaccato alla catena di carbonio.
Video lezione sulle funzioni azotate
Cosa sono le funzioni dell'azoto?
Le funzioni dell'azoto sono un insieme di funzioni organiche che hanno l'atomo di azoto nella loro struttura, oltre agli atomi di carbonio e idrogeno. Sono: ammine, ammidi, nitrocomposti, nitrili e isonitrili,
Ciò che differenzia le funzioni azotate sono i rispettivi gruppi funzionali, che sono la disposizione strutturale degli atomi responsabili delle proprietà della sostanza.
Quali sono le funzioni dell'azoto?
ammine
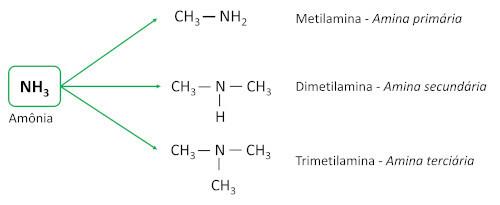
La funzione organica la miniera è caratterizzato legando almeno una catena di carbonio all'atomo di azoto. Il gruppo funzionale delle ammine è -N-R1R2R3 (i gruppi R sono catene di carbonio o atomi di idrogeno, di cui almeno uno è una catena di carbonio).

le ammine derivano dall'ammoniaca (NH3), con uno o più atomi di idrogeno sostituiti da atomi di carbonio o ligandi alchilici. Sono sostanze di base, lasciando il pH maggiore di 7 in soluzione acquosa.
Sono classificati in base alla quantità di atomi di idrogeno sostituiti da ligandi di carbonio (gruppi alchilici o arilici), che sono chiamati sostituenti.
- Ammine primarie: hanno un solo sostituente di carbonio.
- Ammine secondarie: hanno due sostituenti di carbonio.
- Ammine terziarie: hanno tre sostituenti carbonici, cioè l'atomo di azoto non è più legato a nessun atomo di idrogeno, stabilendo tre Connessioni semplice con atomi di carbonio.
UN nomenclatura delle ammine segue le linee guida di IUPAC (Unione Internazionale di Chimica Pura e Applicata). Nel caso delle ammine primarie, la costruzione del nome tiene conto del numero di atomi di carbonio (prefisso), della natura del legame tra atomi di carbonio (infisso) e del termine utilizzato la miniera per il suffisso (fine della parola).

Guarda l'esempio:
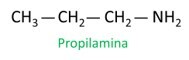
Quando si assegnano i numeri ai carboni per la posizione dei radicali, assegnare il numero più basso possibile all'atomo più vicino al gruppo NH.2.
Per le ammine secondarie e terziarie, la nomenclatura considera il gruppo sostituente più lungo attaccato all'azoto come catena principale, e gli altri ligandi si scrivono con il prefisso riferito al numero di atomi di carbonio e il suffisso -I l, con la lettera N davanti a loro.

Esempio:
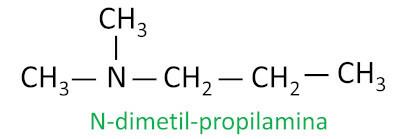
Ammidi
La funzione organica ammide È caratterizzato da legame di un gruppo carbonilico (C=O) all'atomo di azoto, dove l'azoto può essere legato ad atomi di carbonio o idrogeno.
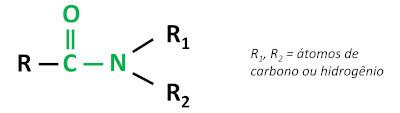
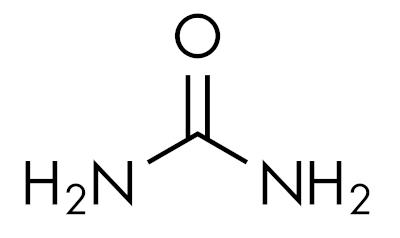
le ammidi sono sostanze basiche, lasciando il pH superiore a 7 in soluzione acquosa. La sostanza urea appartiene al gruppo delle ammidi ed è un composto naturalmente presente nelle urine, derivato dai processi di degradazione che avvengono negli organismi viventi.
Le ammidi sono caratteristiche a seconda del livello di sostituzione dell'azoto. Come questo:
- Amidi primarie: tiene insieme due atomi di idrogeno con l'azoto.
- Ammidi secondarieo monosostituito: uno degli idrogeni è stato sostituito da catena di carbonio, quindi l'azoto mantiene un legame singolo con l'idrogeno.
- ammidi terziarieo sfollati: L'azoto non ha più legami idrogeno, che sono stati tutti sostituiti da atomi di carbonio.

Le ammidi lo sono Nominato secondo IUPAC, le molecole essendo denominate dalla sequenza:

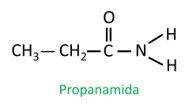
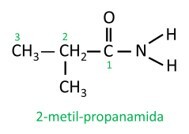
Nell'ammide ramificata, l'atomo di carbonio del gruppo ammidico partecipa alla catena principale e il conteggio del carbonio deve iniziare con esso. Aspetto:
 |
 |
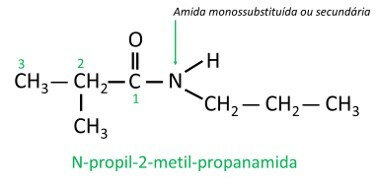
Nelle ammidi monosostituite o disostituite, il la lettera N indica la posizione del ramo che è attaccato all'atomo di azoto. Se c'è un altro radicale nella catena, sarà scritto dopo aver identificato il radicale riferito a N.
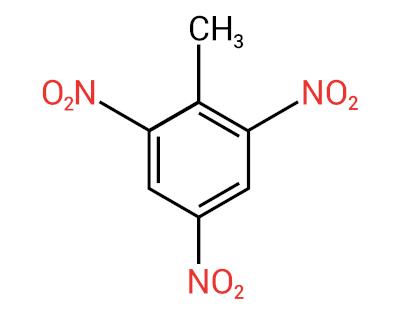
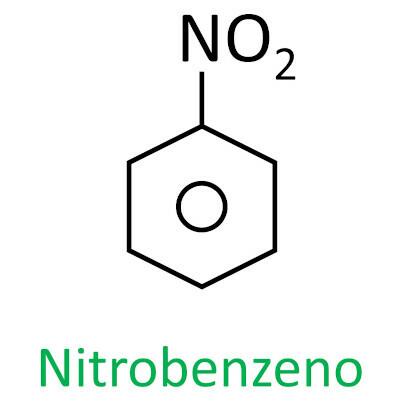
composti nitro
Voi composti nitro sono composti organici che contengono un gruppo nitro (-NO2) attaccato a una catena di carbonio, che può essere alifatico (aperto o lineare) o aromatico.
UN caratteristica principale di queste sostanze è il loro potere esplosivo. La capacità esplosiva è associata ai nitrocomposti aromatici, e maggiore è il numero di gruppi nitro, maggiore è l'esplosione. I composti nitro alifatici sono usati nei laboratori come solventi organici.
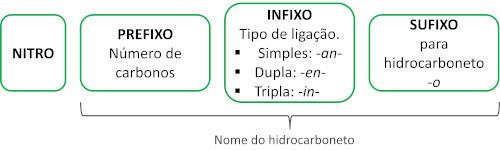
La nomenclatura di questi composti è formata dalla parola nitro seguito dal nome di idrocarburo (prefisso + infisso + finale -O).
Guarda alcuni esempi:
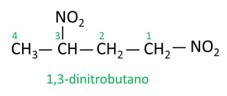 |
 |
nitrili
I nitrili sono composti organici caratterizzati dal triplo legame tra un atomo di carbonio e un atomo di azoto, presentando il gruppo funzionale – C ≡ N. Nei nitrili, l'azoto è all'estremità e il carbonio è attaccato direttamente alla catena di carbonio.

i nitrili Conosciuto anche come cianuri, in quanto derivano da reazioni con acido cianidrico (HCN).
sono sostanze tossico per l'uomo, perché all'interno del corpo possono formare acido cianidrico a contatto con l'acido dello stomaco, prevenendo i processi di respirazione cellulare delle cellule.
In natura i nitrili si possono trovare in alcune drupacee, ma in bassissima concentrazione, non presentando rischi, e nelle foglie della manioca selvatica.

La regola Iupac per la nomenclatura dei nitrili definisce che il termine nitrile essere aggiunto come suffisso:

Guarda alcuni esempi:
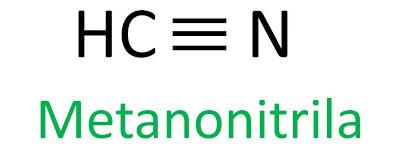 |
 |
La solita forma di nomenclatura per i nitrili è cianuro + nome radicale.
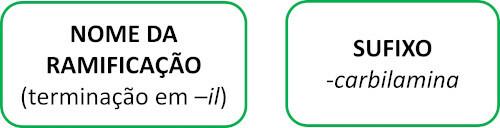
isonitrili
Gli isonitrili, o isonitrili, sono composti formati dal triplo legame tra un atomo di carbonio e un atomo di azoto, presentando il gruppo funzionale – R ≡ C. Negli isonitrili, il carbonio è all'estremità e l'azoto è attaccato direttamente alla catena di carbonio.

Gli isonitrili differiscono dai nitrili per la posizione degli atomi di azoto e carbonio, e Negli isonitrili, l'azoto è caratterizzato come un eteroatomo., poiché è posizionato tra due atomi di carbonio.
Sono specie instabili e possono convertirsi in nitrili a temperature elevate. Le reazioni dell'acido isocianidico danno origine agli isonitrili, motivo per cui questi composti sono noti anche come isocianidi.
Le molecole di isonitrile seguono la regola Iupac per la denominazione:
Guarda alcuni esempi:
 |
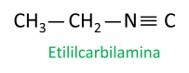 |
Applicazioni delle funzioni dell'azoto
Le sostanze appartenenti alle funzioni azotate hanno numerose applicazioni, principalmente in ambito industriale, per la fabbricazione di polimeri, gomma, fibre sintetiche, prodotti farmaceutici, agrochimici, pesticidi ed esplosivi.
Al le ammine sono utilizzate nella produzione di coloranti, saponi, droghe, in procinto di vulcanizzazione della gomma, esplosivi e altri processi industriali, e si trovano anche nelle piante e si formano nei processi di decomposizione della materia organica.

Al le ammidi trovano ampia applicazione nel settore industriale e chimico, essendo presente nella produzione di polimeri (come nylon e poliuretano), resine, esplosivi, fertilizzanti, repellenti per insetti, fertilizzanti e farmaci.

Voi composti nitroLa sua applicazione principale è la fabbricazione di esplosivi. utilizzati nel settore militare, industriale e metallurgico (per l'estrazione di materie prime). Uno dei nitrocomposti più noti è il trinitrotoluene, popolarmente noto come TNT. Altre applicazioni dei composti nitro sono nella produzione di pesticidi, battericidi, coloranti, raffinazione del petrolio, ecc.

Al i nitrili sono usati come solventi organici in laboratorio e nell'industria, partecipando ai processi di estrazione e lavorazione di alcune fibre sintetiche, polimeri plastici, coloranti e fertilizzanti.

Al gli isonitrili sono impiegati in vari processi per la produzione di composti organici, come i solventi, e partecipano alla produzione di prodotti agrochimici, pesticidi, gomme e materie plastiche.
Leggi anche:Alogenuri: sostanze che hanno atomi di alogeni attaccati alla catena di carbonio
Esercizi risolti sulle funzioni dell'azoto
domanda 1
(FPS-PE-modificato) L'applicazione dei composti azotati nella chimica organica sintetica è molto diversificata e prevede la preparazione di farmaci, coloranti, esplosivi e vitamine. Guarda i composti qui sotto.
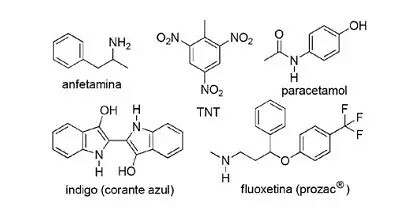
A proposito di questi composti, segna l'affermazione errata.
a) Il TNT è un composto nitro.
b) La parte azotata della fluoxetina è un'ammina secondaria.
c) L'anfetamina è classificata come un'ammide primaria.
d) L'indaco ha anelli eteroaromatici nella sua struttura.
e) La parte azotata del paracetamolo è un'ammide.
Risoluzione:
Lettera C
L'oggetto IL è corretto, perché il TNT è un composto nitro perché NON ha gruppi2.
L'oggetto B è corretta. La porzione azotata della fluoxetina è un'ammina secondaria perché è legata a due segmenti di carbonio.
L'oggetto w non è corretto, poiché l'anfetamina è classificata come un'ammina primaria, non un'ammide. Si noti che il gruppo attuale è NH2. Quindi questo è il succo della questione.
L'oggetto D è corretto, poiché l'indaco ha anelli eteroaromatici nella sua struttura, cioè anelli formati da atomi di carbonio e un altro elemento, in questo caso l'azoto.
L'oggetto È è corretto, perché il paracetamolo è un'ammide, che presenta carbonio legato all'azoto e all'ossigeno.
Domanda 2
(UFMS) Yerba mate (Ilex paraguariense), originario del Sud America, viene utilizzato come bevanda tonica e stimolante. Il prodotto ottenuto dalla lavorazione delle foglie di yerba mate può essere utilizzato per la preparazione chimarrão e tereré, tra le altre bevande comunemente e culturalmente consumate nelle regioni di Argentina, Paraguay e Brasile. Il grande interesse per l'erba mate è dovuto ai composti chimici presenti, per le sue proprietà antiossidanti, stimolanti e diuretiche.
(Disponibile in: http://repositorio.utfpr.edu.br/jspui/bitstream/1/3158/1/PG_PPGEP_Henrique%2C%20 Flavia%20Aparecida_2018.pdf. Accesso: 01 nov. 2018. adattato).
Le proprietà stimolanti della yerba mate sono legate al suo contenuto di metilxantine, una delle principali è la caffeina, struttura presentata di seguito:

Analizzando la formula strutturale della caffeina, è corretto affermare che essa possiede le seguenti funzioni e proprietà organiche:
a) aldeide e ammide, basiche.
b) ammina e ammide, alcalina.
c) ammine e chetoni, alcalini.
d) chetone e ammide, anfotero.
e) acido carbossilico e ammina, basici.
Risoluzione:
Lettera b
Analizzando la struttura della caffeina, si individuano i gruppi funzionali amminico e ammidico, come evidenziato nell'immagine sottostante. Poiché questi due gruppi hanno una caratteristica basica o alcalina, anche la caffeina ha questa caratteristica, il che significa che le soluzioni acquose di caffeina hanno un pH superiore a 7.
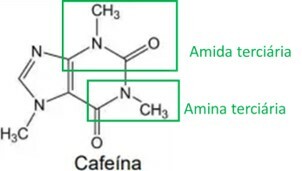
Di Ana Luiza Lorenzen Lima
Insegnante di chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/funcoes-nitrogenadas.htm

