UN sublimazione È un cambiamento dello stato fisico della materia caratterizzato dal passaggio diretto dalla fase solida alla fase gassosa, senza passare per la fase liquida. A rigor di termini, qualsiasi sostanza può subire sublimazione, ma in determinate condizioni di pressione e temperatura. La sublimazione è correlata con la tensione di vapore nella fase solida, nonché con le interazioni intermolecolari esercitate dai solidi.
Questo processo può essere facilmente osservato in un pezzo di ghiaccio secco, costituito da anidride carbonica solida. L'anidride carbonica sublima sotto pressione ea temperatura ambiente. Il processo opposto alla sublimazione può essere chiamato risublimazione o deposizione. Perché avvenga la sublimazione, la materia deve assorbire energia, quindi è considerata un processo endotermico.
Leggi anche: Quali sono gli stati fisici della materia?
Riassunto sulla sublimazione
La sublimazione è il passaggio diretto dalla fase solida alla fase gassosa, senza passare dalla fase liquida.
Per osservare la sublimazione di una sostanza sono necessarie specifiche condizioni di pressione e temperatura.
La sublimazione è influenzata da aspetti termodinamici, come la tensione di vapore nella fase solida e le interazioni intermolecolari.
La sublimazione è un processo endotermico.
Un esempio di sublimazione è quello che avviene nel ghiaccio secco, costituito da anidride carbonica solida.
Cos'è la sublimazione?
la sublimazione è il passaggio diretto dalla fase solida alla fase gassosa, senza passare attraverso la fase liquida. Si verifica in condizioni specifiche di temperatura e pressione per alcuni solidi. Questa transizione è un processo fisico di cambiamento di stato, che non comporta reazioni chimiche.
Il processo inverso, cioè il passaggio diretto dalla fase gassosa alla fase solida, è variamente chiamato. Alcuni autori mantengono la parola sublimazione per questo cambiamento di fase, mentre altri usano "resublimazione" e persino "deposizione".
Come funziona la sublimazione
Si può tracciare un parallelo tra sublimazione ed evaporazione. In entrambi i casi, l'endpoint è fase gassosa. La differenza, ovviamente, sta nella fase di partenza: solido per la sublimazione e liquido per l'evaporazione.
In entrambi i casi, c'è l'influenza della pressione devapore e anche aspetti termodinamici, che coinvolgono il calore e le interazioni intermolecolari.
Cos'è la tensione di vapore?
In un contenitore chiuso contenente un liquido è possibile percepire che esiste un equilibrio tra la fase liquida e la fase vapore. Ciò avviene perché, anche al di sotto della temperatura di ebollizione, l'energia presente è sufficiente perché alcune molecole del liquido si stacchino e passino nel vapore. Tuttavia, alcune molecole di vapore possono anche condensare nuovamente e tornare alla fase liquida, il che dimostra la reversibilità del processo.
Questo vapore, essendo fatto di materia (ha massa e volume), esercizi pressione sulla superficie del liquido, nota come tensione di vapore. Dipende non dalla quantità di liquido, ma dalla temperatura, perché più alta è la temperatura, più facilmente le molecole si staccano dalla fase liquida.
I liquidi che hanno un'elevata tensione di vapore a temperature ordinarie sono chiamati volatili. Ad esempio, a 25°C, l'etere etilico ha una tensione di vapore di 0,58 atm, l'acetone (propanone) ha una tensione di vapore di 0,29 atm, mentre l'acqua ha una tensione di vapore di 0,023 atm. A proposito, quando la tensione di vapore è identica alla pressione atmosferica, il liquido bolle. Per ulteriori informazioni sulla pressione del vapore, fare clic su Qui.
Tensione di vapore e sublimazione
Anche se in misura minore, anche i solidi hanno tensione di vapore, ma molto inferiore a quella dei liquidi. Ad esempio, anche a una temperatura di 1000 K, la tensione di vapore del ferro è solo 9,21 x 10-20 ATM. Tuttavia, alcuni solidi riescono a subire la sublimazione, come lo iodio, presentando una tensione di vapore più elevata a temperature normali (4 x 10-4 ATM).
Questo è possibile solo con il passaggio delle molecole dallo stato solido direttamente allo stato gassoso. Perché ciò avvenga, il devono essere presenti le molecole del solido interazioni intermolecolari Debole (nello iodio, ad esempio, sono del tipo dipolo indotto-dipolo indotto).
Si vede anche questo il processo di sublimazione è endotermico, cioè c'è bisogno che le molecole del solido assorbano energia sotto forma di calore in modo che possano rompere le interazioni intermolecolari e passare allo stato di vapore. La quantità di calore coinvolta può essere misurata da una quantità termodinamica nota come entalpia di sublimazione.
Diagramma delle fasi
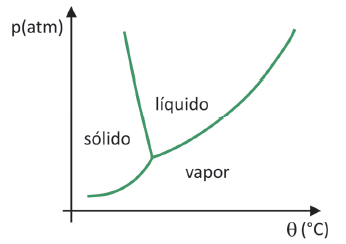
A sapere in quale intervallo di pressione e temperatura avverrà la sublimazione di un solido, è necessario valutare il diagramma di fase. Diamo un'occhiata al caso dell'anidride carbonica, CO2.

In un diagramma di fase, le linee di confine tra gli stati (solido, liquido e gassoso) riuniscono i valori di pressione e temperatura per avviene un cambiamento di stato. Osservando il caso della CO2 si nota che a 1 atmosfera di pressione la fase solida passa direttamente alla fase vapore alla temperatura di -78,5 °C, che caratterizza una sublimazione.
L'anidride carbonica ha una fase liquida solo a pressioni superiori a 5,11 atmosfere e oltre tale pressione la sublimazione non è più possibile. Per ulteriori informazioni sul diagramma di fase, fare clic su Qui.
esempi di sublimazione
Ghiaccio secco: il ghiaccio secco, spesso utilizzato per realizzare effetti nebbia in occasione di feste ed eventi, è in realtà anidride carbonica allo stato solido.

naftalina: le naftalene sono fatte di naftalene, un composto organico aromatico. Viene applicato per rimuovere i cattivi odori e anche per spaventare tarme, scarafaggi e altri animali velenosi, motivo per cui è comune che vengano utilizzati negli armadi o persino negli orinatoi.

Canfora: Con un odore caratteristico, i ciottoli di canfora possono anche subire sublimazione. Servono anche per spaventare le zanzare e prevenire la muffa.

Iodio: anche il non metallo appartenente agli alogeni subisce sublimazione.

Tuttavia, tra le sostanze presentate, solo l'anidride carbonica subisce sublimazione in condizioni ambientali. Gli altri, anche con la sublimazione, possono subire la normale fusione sotto la pressione in cui viviamo.
Leggi anche: Plasma — il quarto stato della materia
Esercizi risolti sulla sublimazione
domanda 1
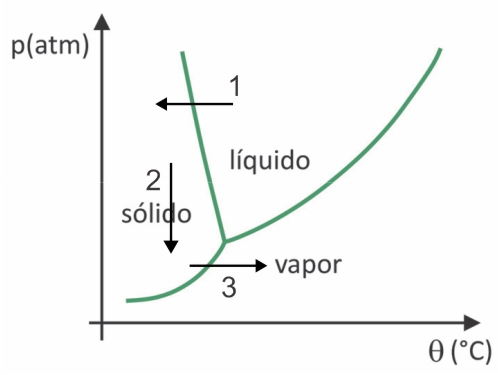
(Fuvest 2020) Nei supermercati è comune trovare i cosiddetti cibi liofilizzati, come frutta, verdura e carne. I cibi liofilizzati sono ancora adatti al consumo dopo molto tempo, anche senza refrigerazione. Il termine "liofilizzato" in questi alimenti si riferisce al processo di congelamento e successiva disidratazione per sublimazione dell'acqua. Perché avvenga la sublimazione dell'acqua, è necessaria una combinazione di condizioni, come mostrato nel grafico pressione-temperatura, dove le linee rappresentano le transizioni di fase.
Nonostante sia un processo che richiede, industrialmente, l'uso di determinate tecnologie, ci sono prove che i popoli i precolombiani che vivevano nelle regioni più alte delle Ande erano in grado di liofilizzare il cibo, rendendolo possibile conservarlo per più tempo. Controlla l'alternativa che spiega come si è verificato il processo naturale di liofilizzazione:
a) La sublimazione dell'acqua è avvenuta a causa delle basse temperature e dell'alta pressione atmosferica in montagna.
b) Il cibo, dopo essere stato congelato naturalmente nei periodi freddi, veniva portato nella parte più bassa delle montagne, dove la pressione atmosferica era più bassa, il che rendeva possibile la sublimazione.
c) L'alimento è stato esposto al sole per aumentarne la temperatura, e la bassa pressione atmosferica locale ne ha favorito la solidificazione.
d) Le temperature erano abbastanza basse nei periodi freddi da congelare il cibo, e la bassa pressione atmosferica in alta montagna rendeva possibile la sublimazione.
e) Gli alimenti, dopo essere stati congelati naturalmente, venivano pressati per aumentare la pressione, in modo che potesse avvenire la sublimazione.
Risposta: Lettera D.
Nella liofilizzazione si ha il congelamento dell'acqua con la sua successiva sublimazione. I popoli precolombiani potevano eseguire un tale processo, poiché in inverno l'acqua poteva gelare (freccia 1) e, con le basse pressioni (freccia 2) delle regioni più alte delle Ande, potrebbe subire sublimazione (freccia 3).
Domanda 2
(Uerj 2005) Il ghiaccio secco, o anidride carbonica solidificata, ampiamente utilizzato nei processi di refrigerazione, subisce sublimazione in condizioni ambientali. Durante questa trasformazione, si verificano, tra gli altri, i fenomeni di variazione di energia e di interruzione delle interazioni.
Tali fenomeni sono classificati, rispettivamente, come:
a) esotermico - interionico
b) esotermico - internucleare
c) isotermo - interatomico
d) endotermico - intermolecolare
Risposta: Lettera D.
La sublimazione è un processo endotermico, in quanto richiede l'assorbimento di calore per interrompere le interazioni che mantengono compatte le molecole in fase solida. Queste interazioni sono di tipo intermolecolare.
Di Stefano Araujo Novais
Insegnante di chimica


