IL hassium, con il simbolo Hs e numero atomico 108, è uno degli elementi noti come transattinidi. Come tutti gli elementi di questo gruppo, non si trova in natura, essendo sintetico, oltre ad essere radioattivo e instabile. La sua sintesi è accreditata ai laboratori tedeschi dell'Helmholtz Center for Research on Heavy Ions (GSI), nella città di di Darmstadium, Germania, e il suo nome è stato dato in onore dello stato tedesco dell'Assia, situato nella regione centrale del genitori.
L'assio è l'elemento più pesante di cui far analizzare le proprietà, attraverso esperimenti effettuati dallo stesso GSI. I risultati sono stati importanti per confermare la posizione di Hs nel Tavola periodica, poiché è stata percepita la somiglianza tra questo elemento e l'osmio e il rutenio, elementi più leggeri del gruppo 8.
Leggi anche:Bohrium — l'elemento chimico sintetico che prende il nome da Niels Bohr
Riepilogo Hassio
È un elemento chimico sintetico situato nel gruppo 8 della tavola periodica.
È stato sintetizzato dalla Gesellschaft für Schwerionenforschung (GSI) a Darmstadium, in Germania.
È un elemento radioattivo e instabile.
Dati teorici e sperimentali confermano che le sue proprietà assomigliano agli elementi più leggeri del suo gruppo.
In quanto transattinide, non può essere prodotto su larga scala, se non al ritmo di pochi atomi.
Proprietà dell'assio
Simbolo: hs
Numero atomico: 108
Massa atomica: 277 c.u.
Configurazione elettronica: [Rn] 7s2 5f14 6d6
Isotopo più stabile: 269Hs (14 secondi di emivita)
Serie chimica: gruppo 8; transattinidi; elementi super pesanti.
Caratteristiche dell'assio
Hassio è un elemento sintetico e il più pesante del gruppo 8. È considerato un transattinide, proprio perché compare nella Tavola Periodica dopo la serie degli attinidi. Come tutti i transattinidi, l'hassium è un elemento radioattivo e instabile.
Ciò significa che i suoi isotopi raggiungono poco tempo di metà vita (il tempo necessario affinché la massa della specie atomica diminuisca della metà). Attualmente sono noti sette isotopi di hassium, la cui massa varia da 264 a.m.u. a 270 a.m.u. Tra tutti, il più stabile è l'isotopo 269Hs, con un'emivita di 14 secondi.
Sebbene la breve emivita renda difficile studiare le proprietà chimiche dei transattinidi, l'hassium ha avuto un po' più di fortuna in questo senso. Nel giugno 2001 è stato annunciato che era diventato l'elemento più pesante per l'analisi delle sue proprietà.
Un team è riuscito, nella città di Darmstádio, in Germania, a produrre circa sei atomi di Hs con un'emivita di circa 10 secondi. Anche se sembra poco, questo è stato sufficiente per confermare che l'ossido di hassio, HsO4, ha forti somiglianze con gli ossidi degli elementi più leggeri del gruppo 8, RuO4 e OsO4, questo è il rutenio è il osmio.
Vedi anche: Seaborgium — un altro elemento chimico sintetico con proprietà radioattive e una breve emivita
Ottenere Hassio
I transattinidi hanno in comune la difficoltà di essere prodotti. In generale, sono necessarie attrezzature all'avanguardia, come ad es acceleratori di particelle. In questi, le specie ioniche si scontrano con elementi di alto massa atomica per formare gli elementi superpesanti (in cui è compreso Hs).
Nel caso dell'assio, gli studi che ne hanno confermato la posizione nel gruppo 8 della Tavola Periodica hanno riguardato la sua produzione attraverso il bombardamento di magnesio-26, con bersaglio di curio-248.
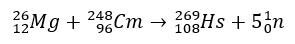
Gli esperimenti che coinvolgono questi elementi sono costosi e, quindi, è normale che vengano effettuati studi teorici, proprio per calcolare e prevedere le proprietà chimiche. La breve emivita è un altro fattore complicante.
Le tecniche sperimentali di separazione e rilevamento deve essere molto veloce per ottenere risultati credibili. Infine, l'efficienza di reazione di questi elementi è molto bassa, essendo nell'intervallo di poche unità atomiche.
Precauzioni con Hassium
Hs non è prodotto su larga scala, e quindi la sua manipolazione non comporta rischi. Inoltre, si ottiene in centri di ricerca con ambienti altamente controllati.
storia di hassium

I transattinidi furono protagonisti di una disputa scientifica a causa del Guerra fredda, un Guerra di trasferimenti, nome coniato in riferimento alle controversie che riguardavano la produzione e il riconoscimento di elementi dopo il fermio (Fm, Z = 100). In questa gara sono stati coinvolti i laboratori:
Joint Institute for Nuclear Research, nella città di Dubna, Russia;
Lawrence Berkeley National Laboratory a Berkeley, California;
Gesellschaft für Schwerionenforschung (GSI, meglio tradotto come Helmholtz Center for Research on Heavy Ions) a Darmstadium, Germania.
Nel caso dell'elemento 108 sono stati coinvolti i gruppi GSI e Dubna. Tuttavia, sebbene gli scienziati Dubna (guidati da Yuri Oganessian) abbiano segnalato per primi la presenza dell'elemento 108, quelli del gruppo tedesco si sono presi il merito, in quanto il GSI ha presentato risultati più convincenti, mentre in un esperimento è riuscito a produrre tre atomi dell'isotopo 265, mentre in un altro ha prodotto un atomo dell'isotopo 264.
Questi isotopi sono stati prodotti utilizzando l'Universal Linear Accelerator (Unilac, meglio tradotto come Universal Linear Accelerator), con bombardamento del 208Pb di 58Fede. Nel 1997, l'Unione Internazionale di Chimica Pura e Applicata (IUPAC) ha riconosciuto l'elemento 108, con il simbolo Hs, come Hassium in onore dello stato tedesco dell'Assia.
Esercizi risolti su hassium
domanda 1
L'assio, simbolo Hs, è considerato l'elemento più pesante per cui le sue proprietà sono state studiate sperimentalmente. A quel tempo, i ricercatori sono stati in grado di determinare le proprietà del tetrossido di hasio, HsO4. In questa specie, Hs ha gli stessi NOx degli elementi più leggeri del suo gruppo, l'osmio (Os) e il rutenio (Ru). Il numero di ossidazione di Hs nel tetrossido di hasio è uguale a:
a) 0
B) +2
C) +4
D) +6
E) +8
Risoluzione:
Alternativa E
IL ossigeno, quando in a ossido, acquista un addebito pari a -2. Così la NOx di Hs, che chiameremo x, può essere calcolato come:
x + 4(-2) = 0
x - 8 = 0
x = +8
Domanda 2
L'isotopo più stabile di hassium, Hs, ha un'emivita di soli 14 secondi. Questo significa:
A) in 14 secondi la massa dell'isotopo di Hs sarà raddoppiata.
B) dopo 14 secondi, la massa dell'isotopo Hs sarà inferiore alla metà della massa iniziale.
C) in poco meno di un minuto, la massa dell'isotopo Hs sarà 1/16 della sua massa iniziale.
D) in un minuto, la massa dell'isotopo Hs sarà esattamente la metà della sua massa iniziale.
E) in 14 secondi la massa dell'isotopo Hs sarà divisa per 4.
Risoluzione:
Alternativa C
L'emivita indica il tempo necessario affinché la quantità delle specie atomiche si dimezzi. Ciò significa che ogni 14 secondi la quantità di Hs diminuisce della metà. Osservando questa emivita, è chiaro che, con 56 secondi, sono già state raggiunte quattro emivite, facendo dividere la massa di Hs per 24, che è 16.
Di Stefano Araújo Novais
Insegnante di chimica

