IL borgio di mare, simbolo Sg e numero atomico 106, è un elemento chimico sintetico collocato nel gruppo 6 della Tavola Periodica. La sua scoperta risale al 1974, essendo attribuita al gruppo americano guidato da Albert Ghiorso e che ebbe il contributo di Glenn Seaborg, il cui nome diede origine al termine seaborgium. Come molti elementi di questa regione del Tavola periodica, il nome del seaborgium è stato ufficializzato solo nel 1997, a causa di controversie e trattative tra gruppi di scienziati.
Sebbene ci siano ricercatori impegnati a studiarlo, il seaborgium ha scarso uso pratico. Ciò è dovuto alle difficoltà nel sintetizzare gli isotopi di questo elemento, nonché alla loro bassa stabilità. L'isotopo più stabile del seaborgio, ad esempio, ha un'emivita di circa cinque minuti.
Vedi anche: Dubnio — un altro elemento chimico sintetico nel gruppo 6 della tavola periodica
Riepilogo sul seaborgio
- È un elemento chimico sintetico situato nel gruppo 6 della tavola periodica.
- È stato sintetizzato per la prima volta nel 1974 da due gruppi distinti.
- È un elemento radioattivo.
- Non si sa ancora molto sul seaborgium, poiché raramente vengono prodotti campioni stabili in quantità significative.
- L'elemento è stato ufficializzato come seaborgium solo nel 1997, in onore dello scienziato Glenn Seaborg.
Non fermarti ora... C'è altro dopo l'annuncio ;)
proprietà del seaborgio
- Simbolo: sg.
- Numero atomico: 106.
- Massa atomica: 269 uc
- Configurazione elettronica: [Rn] 7s2 5f14 6d4.
- Isotopi più conosciuti: 269Sg (5 ± 3 minuti di emivita); 271Sg (3,1 ± 1,6 minuti di emivita).
- Serie chimica: gruppo 6; transattinidi; elementi super pesanti.
Caratteristiche del seaborgio
È caratteristico degli elementi transattinidi di essere radioattivi.. Questi sono gli elementi con numero atomico maggiore o uguale a 104 (da ruterfordio, Rf). Tuttavia, c'è stata una ricerca sfrenata di questi elementi in natura e una teorizzazione sull'"isola della stabilità".

Rappresenterebbe una regione atomica superpesante in cui il numero di protoni sarebbero, in media, 114, e gli elementi ne avrebbero una grande metà vita (tempo necessario alla riduzione della metà della massa campionaria), presentandosi come praticabile e accessibile per studi sperimentali.
Tuttavia, dagli anni '50 sono stati compiuti numerosi sforzi per trovare tracce naturali di questi elementi, a metà degli anni '80 Georgy Flerov e Gurgen Ter-Akopian dissero di non avere alcuna speranza di trovarli nel natura.
Come con altri elementi transattinidi, è difficile studiare ampiamente il seaborgio. Questo perché è possibile solo sintetizzarepiccole quantità, che hannoemivita molto breve, cioè ce ne sono pochi atomi e tengono per qualche minuto.
Ciò ha consentito di affermare che il seaborgium sarebbe, infatti, del gruppo 6, come nel caso del composto SgO2cl2, che per certi aspetti somigliava ai composti analoghi di elementi stabili del gruppo, come WO2cl2 e MoO2cl2.
Leggi anche:Elementi transuranici: elementi artificiali che vengono dopo l'uranio nella tavola periodica
Ottenere Seaborgium
Poiché il seaborgium è un elemento sintetico, è importante notare che non si trova in natura. Una barriera nell'ottenere il seaborgio, oltre al fatto che è possibile sintetizzarne solo piccole quantità, è quella ottenerlo richiede macchinari ad alta tecnologia e condizioni estreme.
Atomi come il seaborgium si formano dalla reazione di Fusione di atomi più leggeri utilizzando raggi ionici energia molto elevata e sono disponibili per lo studio solo in ambienti considerati ostili alla maggior parte dei sistemi chimici: utilizzando un raggio di plasma indotta in grandi acceleratori di particelle.

Storicamente, il seaborgium è stato sintetizzato attraverso la collisione di ioni18Il (ossigeno-18) avendo il 249Cf (californio-249) come bersaglio. Così, attraverso l'analisi dei decadimenti delle particelle alfa, è stata confermata la sintesi dell'elemento 106.
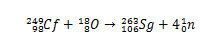
Precauzioni con Seaborgium
Gli elementi chimici come il seaborgio non presentano grandi rischi, poiché non vengono prodotte quantità sufficienti di questo elemento per rimanere stabili a lungo. Tutta la cura che deve essere presa è relativa al campioni radioattivi, in grado di generare Radiazione ionizzante nei processi di decadimento.
Saperne di più: Incidente di Chernobyl: il più grande incidente nucleare della storia
storia di Seaborgium
Come altri elementi super pesanti, il seaborgium fu scoperto nel contesto della cosiddetta Guerra dei Trasferimenti, un pezzo di Guerra fredda nella storia di Chimica e la tavola periodica.
Questa guerra è stata una disputa sulla preferenza nel nominare il elementi chimici scoperto dopo il fermio (Fm, Z = 100), più specificamente tra gli elementi di numero atomico da 104 a 109, che si sono verificati durante il periodo della Guerra Fredda.
In tale contenzioso i laboratori hanno gareggiato:
- Joint Institute for Nuclear Research in Dubna (ex parte del Unione Sovietica);
- Lawrence Berkeley National Laboratory presso l'Università della California, Berkeley (stati Uniti);
- Gesellschaft für Schwerionenforschung, a Darmstadt (Germania).
In particolare nel caso del seaborgium, il controversia si è verificata tra i laboratori Dubna e Berkeley. Questo perché, nel 1974, entrambi i laboratori affermavano di essere riusciti a sintetizzare l'elemento 106.
Tuttavia, un rapporto congiunto che conteneva membri dell'Unione internazionale di chimica pura e applicata (IUPAC) e di Pure and Applied Physics (Iupap), realizzato nel 1993, ha concluso che, sebbene molto importante per gli sviluppi futuri, voi gli esperimenti nei laboratori di Dubna non hanno dimostrato la formazione dell'elemento 106 in modo convincente, accreditando così ai Berkeley Laboratories la scoperta del nuovo elemento.
La Iupac Inorganic Compounds Nomenclature Commission (CNIC) ha persino proposto il nome rutherfordium per l'elemento 106, ignorando le proposte dei ricercatori. Dopo molte discussioni, il team di Berkeley Labs, guidato da Albert Ghiorso, decise, quanto al nome, di onorare il collega Glenn Theodore Seaborg, Ppremio Nobel di Chimica nel 1951, nominando l'elemento seaborgium.
Suo figlio Eric Seaborg ha persino raccontato, in un articolo, la reazione di suo padre all'idea:
Ghiorso si avvicinò ai membri della squadra uno per uno finché sette di loro annuirono. Ha poi detto al suo amico e collega da 50 anni: “Abbiamo sette voti a favore della denominazione dell'elemento 106 come seaborgium. Accetteresti?". Mio padre rimase stupito e, dopo aver consultato mia madre, accettò.
Risolti esercizi su seaborgium
domanda 1
Seaborgium ha un isotopo, massa 269, la cui emivita stimata è di 5 minuti. In un esperimento per la sua sintesi, gli scienziati sono riusciti a rilevare, dopo 25 minuti, 0,0025 mg dell'isotopo 269 del seaborgium. La massa iniziale del seaborgium era:
A) 0,0025 mg
B) 0,0050 mg
C) 0,0100 mg
D) 0,0200 mg
E) 0,0800 mg
Risoluzione:
Alternativa E
L'emivita è il tempo necessario affinché la quantità di un campione radioattivo diminuisca della metà. In 25 minuti si sono verificate 5 emivite di seaborgium. Pertanto, è possibile fare un'analisi retroattiva:
- Da 0,0050 mg a 0,0025 mg (5a emivita)
- Da 0,0100 mg a 0,0050 mg (4a emivita)
- Da 0,0200 mg a 0,0100 mg (3a emivita)
- Da 0,0400 mg a 0,0200 mg (2a emivita)
- Da 0,0800 mg a 0,0400 mg (1a emivita)
Domanda 2
Nel 1974, a Berkeley, in California, il gruppo guidato da Albert Ghiorso riuscì a sintetizzare l'elemento 106, durante la famosa Guerra di Trasferimento, una parte della Guerra Fredda nella storia della chimica. Questo nuovo elemento aveva, oltre al numero atomico 106, un numero di massa di 263. Nel 1997 è stato ufficializzato un seaborgium, in riferimento all'amico e collega di Ghiorso Glenn Seaborg, vincitore del Premio Nobel per la Chimica nel 1951 e anche membro del gruppo che riuscì a sintetizzare il nuovo elemento.
Dai dati presentati, è possibile concludere che il numero di neutroni nel seaborgio sintetizzato è uguale a:
R) 155
B) 157
C) 159
D) 106
E) 263
Risoluzione:
Alternativa B
Il numero di neutroni di un atomo può essere calcolato come segue:
A = Z + n
A è il numero di pasta, Z è il numero atomico e n è il numero di neutroni.
Sostituendo i dati forniti dalla domanda, abbiamo:
263 = 106 + n
n = 157
Di Stefano Araújo Novais
Insegnante di chimica



