Elettrolisi si tratta di un processo non spontaneo, cioè non naturale, in cui le sostanze si formano per scarica elettrica in composti fusi o disciolti in acqua. In questo processo, una corrente elettrica raggiunge un contenitore di vetro (vasca elettrolitica) che ha due elettrodi inerti (che non soffrono o ossidazione né riduzione) formato da grafite o platino. Questi elettrodi sono collegati a una sorgente elettrica (solitamente a batteria) e immerso in un sale o una base fusa o disciolta in acqua. Proprio come il batteria, l'elettrolisi ha un catodo (dove avviene la riduzione) e un anodo (dove avviene l'ossidazione).
Sommario
L'elettrolisi è un processo non spontaneo;
Si possono formare sostanze semplici o composite;
Può verificarsi con un soluto fuso (elettrolisi ignea);
Può verificarsi con un soluto disciolto in acqua (elettrolisi acquosa);
Un catione subisce sempre una riduzione al catodo;
Un anione subisce sempre ossidazione all'anodo.
Vedi anche:Ottenere alluminio dall'elettrolisi

Tipi di elettrolisi
È un'elettrolisi che si verifica quando viene effettuata una scarica elettrica su un composto ionico fuso. Il composto ionico è quello formato da un legame ionico, come a sale o un base inorganico. Quando parliamo di composto fuso, a sua volta, ci riferiamo al composto che passa dallo stato solido allo stato liquido.
- Esempio di elettrolisi ignea
Quando eseguiamo la fusione del cloruro di potassio (KCl), questo sale subisce il processo di dissociazione, liberando il catione potassio (K+) e l'anione ioduro (l-).

Equazione di dissociazione per cloruro di potassio
Quando la corrente elettrica arriva nella cella elettrolitica con questi ioni, il catione potassio va incontro a riduzione, formando potassio metallico (K), e l'anione ioduro subisce ossidazione, formando iodio solido (I2).
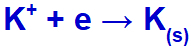
Equazione di formazione del potassio solido
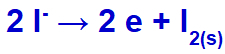
Equazione di formazione dello iodio solido
È un'elettrolisi che si verifica quando la scarica elettrica viene effettuata su una soluzione acquosa (ha acqua) formata da un sale o da una base inorganica.
- Esempio di elettrolisi acquosa
Quando dissolviamo il cloruro di sodio in acqua, si dissocia e l'acqua subisce la ionizzazione:

Equazioni di ionizzazione dell'acqua ed equazioni di dissociazione del cloruro di sodio
Come catione di sodio (Na+) appartiene alla famiglia IA, il catione idronio (H+) passa attraverso lo scarico e va incontro a riduzione, formando gas idrogeno (H2).
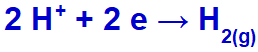
Equazione di formazione del gas idrogeno
Come cloruro (Cl-) non è ossigenato (non ha ossigeno) e non è fluoruro (F-), si scarica ossidandosi e formando cloro gassoso (Cl2).

Equazione di formazione del gas di cloro
Scarica ionica selettiva
Durante un processo di elettrolisi in un mezzo acquoso (soluzione formata da acqua e un soluto), avremo sempre due cationi: l'idronio, dall'acqua, e qualsiasi altro, dal dissociazione del sale (esempio di soluto). Avremo anche due anioni: l'idrossile, che deriva dall'acqua, e un altro, che deriva dal sale.

Ioni dalla ionizzazione dell'acqua e dalla dissociazione del sale
- Scarico selettivo per cationi e anioni
Se il catione del soluto appartiene alla famiglia IA, IIA o IIIA, l'idronio (H+) sarà ridotto;
Se il catione proveniente dal soluto non appartiene alle famiglie sopra menzionate, subirà la riduzione.
Se l'anione del soluto ha ossigeno nella sua composizione o è un fluoruro (F-), l'idrossido (OH-) subirà ossidazione;
Se l'anione del soluto non ha le caratteristiche di cui sopra, subirà ossidazione.
È noto che l'acqua ha la capacità di autoionizzarsi, producendo ioni idronio (H+) e idrossido (OH-), ma questa ionizzazione è molto limitata. Questo fatto è dimostrato dall'inefficienza dell'acqua pura nel condurre la corrente elettrica.
Ad esempio elettrolisi comporta una scarica elettrica, per effettuare l'elettrolisi dell'acqua è necessario sciogliere un soluto, il che favorisce lo scarico selettivo di idronio e idrossido (come visto nell'argomento scarico selettivo).
Se aggiungiamo solfato di sodio (Na2SOLO4), ad esempio avremo nel mezzo i cationi sodio (Na+) e idronio (H+), così come anioni idrossido (OH-) e solfato (SO4-2). Quindi, quando la corrente elettrica arriva nel serbatoio elettrolitico:
l'idronio verrà scaricato, riducendosi, perché il sodio appartiene alla famiglia IA;
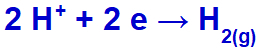
Equazione di formazione del gas idrogeno
l'idrossido andrà incontro a scarica, ossidandosi, perché il solfato ha ossigeno nella sua composizione.
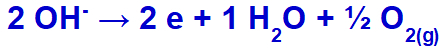
Equazione di formazione del gas di ossigeno
Poiché i due ioni (catione e anione) provenienti dall'acqua si sono scaricati, diciamo che è avvenuta l'elettrolisi dell'acqua.
Vedi anche: Aspetti quantitativi dell'elettrolisi
Produzione di sostanze semplici come il gas idrogeno (H2), gas ossigeno (O (2) eccetera.;
Produzione di sostanze composite come idrossido di sodio (NaOH), acido solforico (H2SOLO4) eccetera;
Rivestire una parte con un metallo particolare, come rame (rame) e oro (placcatura in oro);
Utilizzare per rimuovere un determinato metallo dal minerale.
Esercizi risolti sull'elettrolisi
Esempio 1 - (Vunesp) Una soluzione acquosa di CuCℓ2 viene sottoposto ad elettrolisi, utilizzando elettrodi di platino. L'affermazione corretta è:
a) La riduzione dello ione Cu avviene al catodo2+.
b) L'ossidazione dello ione Cu avviene all'anodo2+.
c) Si forma cloro gassoso al catodo.
d) Parte dell'anodo di platino si dissolve, formando Pt2+.
e) I prodotti di questa elettrolisi sarebbero diversi se l'elettrolisi di CuCl2 erano ardenti (fusione).
a) Corretto. Quando CuCl2 è disciolto in acqua, abbiamo i cationi idronio (H+) e rame II (Cu+2). Poiché il catione rame II non appartiene alle famiglie IA, IIA e IIIA, è ridotto.
b) Falso, in quanto l'anione cloruro (Cl) è ossidato all'anodo-), che non ha ossigeno nella sua composizione e non è fluoruro (F-).
c) Falso, perché la riduzione del catione rame II avviene al catodo, quindi si ha formazione del rame metallico.
d) Falso, poiché gli elettrodi di platino o di grafite nell'elettrolisi conducono solo elettricità, non partecipano al processo.
e) Falso, poiché l'elettrolisi ignea del cloruro di rame II (CuCl2) presenterebbe esattamente gli stessi prodotti di quello acquoso, in quanto gli ioni presenti sarebbero il rame II (Cu+2) e il cloruro (Cl-1).
Esempio 2- (UFRN) Considera i seguenti sistemi:
IO. Cloruro di sodio fuso;
II. Soluzione acquosa di cloruro di sodio;
III. Idrossido di sodio fuso;
IV. Soluzione acquosa di idrossido di sodio.
Quelli che possono fornire sodio, se sottoposti ad elettrolisi, sono:
a) solo I e II.
b) solo I e III.
c) solo II e IV.
d) solo III e IV.
e) I, II, III e IV.
I sistemi che forniscono sodio metallico come prodotto al catodo sono I e III.
I- L'unico catione presente nel mezzo è il catione sodio, quindi solo lui può ridursi formando sodio metallico.
II- Questo sistema non fornisce sodio metallico perché il cloruro di sodio è stato sciolto in acqua, quindi nel mezzo abbiamo la presenza di cationi di sodio (Na+) e idronio (H+) - questo è colui che subisce la riduzione, in quanto il sodio appartiene alla famiglia IA.
III- L'unico catione presente nel mezzo è il catione sodio (perché il materiale è stato sottoposto a fusione), quindi solo esso subisce una riduzione, formando sodio metallico;
IV- Questo sistema non fornisce sodio metallico perché l'idrossido di sodio è stato sciolto in acqua, quindi nel mezzo abbiamo la presenza di cationi di sodio (Na+) e idronio (H+) - questo è colui che subisce la riduzione, in quanto il sodio appartiene alla famiglia IA.
Di Me. Diogo Lopes Dias
