Soluzione tampone è una miscela omogenea che non cambia pH o pOH quando vengono aggiunte piccole quantità di acido forte o base forte a questa miscela. Tuttavia, la miscela non cambia pH o pOH solo se presenta una delle due composizioni seguenti:
Spina acido (pH inferiore a 7):
Ha acido debole mescolato con a sale solubile che ha lo stesso anione, come l'acido cianidrico (HCN) e il cianuro di potassio (KCN), che hanno lo stesso anione cianuro (CN).
Tampone di base (pH maggiore di 7):
Base debolmente miscelato con un sale che ha lo stesso catione, come l'idrossido di zinco [Zn(OH)2] e cloruro di zinco (ZnCl2), che hanno lo stesso catione di zinco (Zn+2).
È importante, per comprendere l'influenza che una soluzione tampone ha sulla ricezione di un acido o una base forti, ricordare quando acidi e basi sono considerati forti:
→ Classifica delle basi in termini di forza
forte: basi con elementi chimici delle famiglie IA (metalli alcalini) e IIA (metalli alcalino terrosi), ad eccezione del magnesio;
debole
: basi che hanno l'elemento magnesio e un altro, purché non appartenga alle famiglie IA e IIA.
→ Classificazione di acido per forza
a) Per gli idrati (acidi privi di ossigeno):
forte: solo HCl, HBr e HI;
moderati: solo HF;
debole: qualsiasi altro idrossido.
b) Per ossiacidi (acidi con ossigeno):
forte: quando la sottrazione del numero di ossigeni per il numero di idrogeni è uguale o maggiore di 2;
moderati: quando la sottrazione del numero di ossigeni per il numero di idrogeni è uguale a 1;
debole: quando la sottrazione del numero di ossigeni per il numero di idrogeni è uguale o inferiore a 0.
Influenza dell'aggiunta di una base forte a un tampone
Per spiegare, usiamo il soluzione tampone formato da idrossido di zinco [Zn(OH)2] e il sale solubile del cloruro di zinco (ZnCl2), che riceverà una piccola quantità di base forte di idrossido di sodio (NaOH). Vedi i saldi presenti in questa soluzione tampone:
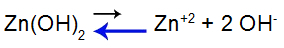
Equazione di equilibrio di dissociazione di base
L'equilibrio si sposta a sinistra perché la base è debole.
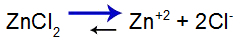
Equazione di equilibrio di dissociazione del sale
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
L'equilibrio si sposta a destra perché il sale è solubile.
La base forte ha il seguente equilibrio:
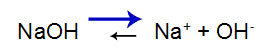
Equazione di equilibrio di dissociazione di base
L'equilibrio si sposta a destra perché la base è forte.
La base forte aggiunta rilascia l'anione idrossido (OH) in acqua-), che ha un'elevata affinità per i cationi di zinco (Zn+2) dal sale nel secondo equilibrio. L'associazione tra idrossido e zinco forma idrossido di zinco:
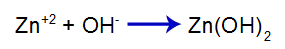
equazione di formazione delle basi
Quindi l'OH- di base diminuisce la quantità di zinco nel secondo equilibrio e aumenta la quantità di base [Zn(OH)2], facendolo dissociare ulteriormente e rilasciare cationi Zn+2 nel primo equilibrio. Poiché non avremo un cambiamento nella quantità di idrossido nel mezzo, quindi, il pH non cambia.
Influenza dell'aggiunta di un acido forte a un tampone
Per spiegare, usiamo il tampone formato da idrossido di zinco [Zn(OH)2] e dal sale solubile del cloruro di zinco (ZnCl2), che riceverà una piccola quantità di acido iodidrico (HI), che è forte. Vedi i saldi presenti nel cap:
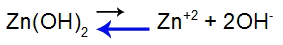
Equazione di equilibrio di dissociazione di base
Bilancia spostata a sinistra perché la base è debole.
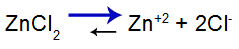
equazione di equilibrio del sale
Equilibrio spostato a destra perché il sale è solubile.
L'acido forte ha il seguente equilibrio:
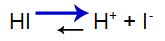
Equazione dell'equilibrio acido
Equilibrio spostato a destra perché l'acido è forte.
L'acido aggiunto produce il catione idronio in acqua (H+), che ha un'elevata affinità per gli ioni idrossido (OH-) dalla base. L'associazione tra idronio e idrossido forma una molecola d'acqua:
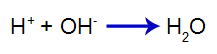
equazione di formazione dell'acqua
Quindi l'H+ di acido diminuisce la quantità di idrossidi nel primo equilibrio, aumentando la dissociazione delle basi. Poiché non avremo un cambiamento nella quantità di idrossido nel mezzo, quindi, il pH non cambia.
Di Me. Diogo Lopes Dias
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Aspetto:
GIORNI, Diogo Lopes. "Cos'è una soluzione tampone?"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-solucao-tampao.htm. Consultato il 27 luglio 2021.



