Le molecole delle sostanze non sono tutte diritte, come se fossero su un unico piano. Dopotutto, sono sparsi nello spazio e i loro atomi assumono disposizioni o disposizioni diverse. Pertanto, esistono diverse forme geometriche per le molecole di ciascun tipo di sostanza.
Uno dei modi più semplici per determinare la geometria di una molecola si basa sulla teoria di repulsione delle coppie di elettroni del guscio di valenza (RPECV). Secondo questa teoria, le coppie di elettroni dell'atomo centrale funzionano come nuvole elettroniche che si respingono. In questo modo, sono orientati il più lontano possibile l'uno dall'altro. La geometria molecolare dipenderà dal numero di coppie elettroniche attorno all'atomo centrale.
Questa nuvola elettronica può essere composta da elettroni che partecipano a legami (singoli, doppi o tripli) e anche che non partecipano. Quindi abbiamo:
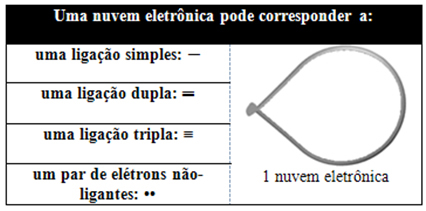
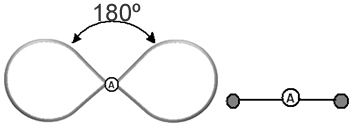
Aiuta a pensare a questa nuvola come a un palloncino o palloncini legati, con l'atomo centrale al centro di essi. Ad esempio, in una molecola che ha solo due nuvole di elettroni attorno all'atomo centrale, maggiore è la distanza possibile tra loro è un angolo di 180º e, di conseguenza, la geometria della molecola sarà lineare.
Pertanto, possiamo dedurre come sarà la geometria molecolare della maggior parte delle molecole se teniamo conto del numero di atomi nelle molecole, e i legami che l'atomo centrale forma, controllando se ha o meno coppie di elettroni.
Vedere gli esempi di seguito:
- Molecole con 2 atomi: sempre lo saranno lineare
Per esempio:
H ─ H, H ─ Cl, F ─ F, O ═ O, C ≡ O.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
- Molecola a 3 atomi: angolare o triangolare
se l'atomo centrale possedere una coppia di elettroni non vincolanti la geometria sarà angolare, come nel caso della molecola SO2:
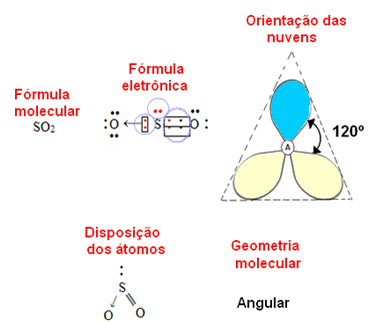
Considera la nuvola di elettroni blu per rappresentare coppie di elettroni che non partecipano ai legami e quella gialla come coppie di elettroni che partecipano ai legami.
- Molecola a 4 atomi: piano trigonale (o triangolare) o piramidale (o piramide trigonale)
Se l'atomo centrale non ha una coppia di elettroni spaiati (non di legame), la geometria molecolare è trigonale piatta (o triangolare). Guarda l'esempio BF3:

Se l'atomo ha coppie di elettroni non leganti, la geometria della molecola sarà piramidale (o piramide trigonale), come nel caso dell'ammoniaca:

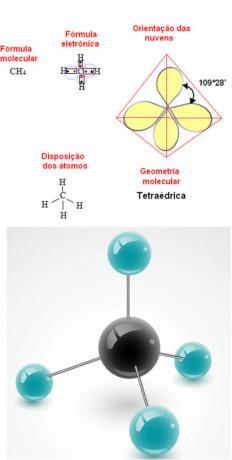
- Molecola a 5 atomi: tetraedrico
Esempio di geometria del metano:
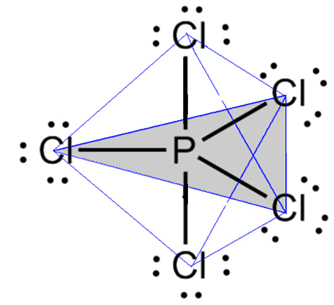
- Molecola con 6 atomi: bipiramide trigonale o piramide triangolare.
Un esempio è il pentacloruro di fosforo (PCl5), che ha alcune connessioni tra fosforo e cloro con un angolo di 90º e altre di 120º, formando una bipiramide a base triangolare:
- Molecola a 7 atomi: ottaedrico
Esempio: esafluoruro di zolfo (SF6), i cui angoli sono 90º.

di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Aspetto:
FOGAÇA, Jennifer Rocha Vargas. "Determinazione della geometria delle molecole"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/determinacao-geometria-das-moleculas.htm. Consultato il 27 luglio 2021.