In reazioni di ossidazione con alcoli secondari sono quelli in cui l'interazione tra un composto organico del gruppo di alcoli, che deve essere secondario, e il cosiddetto reagente di Bayer (KMnO4) in ambiente acido.
Ogni volta che il reagente di Bayer si trova in un mezzo acido (aq/H+), subisce una reazione di decomposizione, originando ossido di potassio, ossido di manganese II e ossigeni nascenti, come si vede dalla seguente equazione:
2 kmnO4(acquosa/H+) → 2 MnO + K2O + 5 [O]
In ogni reazione di ossidazione, il ossigeni nascenti, originato dalla decomposizione del permanganato di potassio in ambiente acido, attaccare le catene di carbonio che hanno legami pi tra i carboni (alcheni, alchini e alcadieni) o che sono chiusi (ciclani, cicli aromatici), generando nuovi composti chimici.
In caso di reazione di ossidazione in alcoli secondari, prima di comprendere il meccanismo di reazione, è necessario ricordare il concetto di alcol secondario. è chiamato alcol secondario quella in cui l'idrossile (OH) è legato ad a
carbonio secondario (carbonio legato direttamente ad altri due atomi di carbonio). Vedere la rappresentazione di un alcol secondario: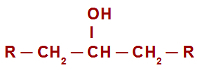
Formula generale di struttura di un alcol secondario
In ogni reazione di ossidazione negli alcoli, gli ossigeni nascenti attaccano gli idrogeni situati sul carbonio che ha il gruppo ossidrile. Nel caso delle reazioni di ossidazione negli alcoli secondari, gli ossigeni hanno un solo atomo di idrogeno da attaccare in ciascuna struttura di questo tipo di alcol.
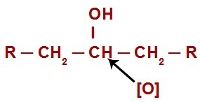
Ossigeno nascente che attacca un alcol secondario
Quando attacca l'idrogeno (H) presente nel carbonio idrossile (OH), l'ossigeno nascente ([O]) forma un nuovo idrossile sullo stesso carbonio. Quindi abbiamo un gemino diol in prigione. Poiché il gemino diolo (HO – C – OH) è instabile, si decompone in una molecola d'acqua.Tuttavia, tra il carbonio e l'ossigeno residuo di uno degli ossidrili, si ha la formazione di un doppio legame (pi e sigma).
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
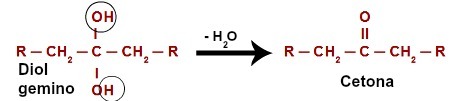
Equazione chimica dell'ossidazione di un alcol secondario
Il prodotto originato da una reazione di ossidazione degli alcoli secondari è sempre a chetone, poiché il doppio legame è sempre generato al carbonio secondario, che si traduce in un carbonile tra due atomi di carbonio, formando così un chetone.
Vedi ora a esempio della reazione di ossidazione negli alcoli secondari.
Esempio: Butan-2-olo
oh il butan-2-olo è un alcol secondario, poiché l'idrossile è attaccato a un atomo di carbonio secondario. Quindi, sul carbonio che ha l'ossidrile, c'è solo un idrogeno. Possiamo verificare questo fatto nella struttura sottostante:

Quando sottoposto a un mezzo contenente acqua, acido e KMnO4 (reagente di Bayer), il il tuo idrogeno viene attaccato da un ossigeno nascente, trasformandosi in un nuovo idrossile, che si traduce in un gemino diolo.

Infine si ha una decomposizione dei due ossidrili presenti nel gemino diolo, risultando così una molecola d'acqua e un chetone, per la necessità di creare un legame tra il carbonio e uno degli ossigeni degli ossidrili decomposti.

possiamo rappresentare l'intera reazione di ossidazione del butan-2-olo dalla seguente equazione:

Di Me. Diogo Lopes Dias
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Aspetto:
GIORNI, Diogo Lopes. "Reazioni di ossidazione in alcoli secondari"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/reacoes-oxidacao-alcoois-secundarios.htm. Consultato il 27 luglio 2021.
Chimica

Gruppo funzionale ossidrile, Alcoli primari, Alcoli secondari, Alcoli terziari, Metanolo, Glicerolo, Etanolo, preparazione di nitroglicerina, fabbricazione di vernici, produzione di bevande alcoliche, acido acetico, carburante per automobili.


