Ossidazione è il nome dato al processo di perdita di elettroni da parte di un atomo, gruppo o specie ionica durante a reazione chimica. Si identifica dall'aumento di NOX (numero di ossidazione) della specie o dell'atomo quando si confrontano reagenti e prodotti.
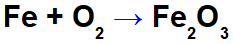
Equazione di ossidazione del ferro.
Nell'equazione sopra, ad esempio, possiamo indicare il NOX di ciascuno dei partecipanti:
Ferro reagente (Fe): ha NOX 0 in quanto è a sostanza semplice;
Ossigeno nel reattivo (O): ha NOX 0 in quanto sostanza semplice;
Ossigeno nel prodotto: ha NOX -2 perché non è legato ad un metallo alcalino, terre alcaline o formazione di idrogeno perossidi o superossidi;
Ferro nel prodotto: ha NOX +3 perché la somma degli NOX di ferro moltiplicata per 2 (numero di atomi) + NOX di ossigeno moltiplicata per 3 deve risultare 0 in quanto è una sostanza composta:
x.2 + 3.(-2) = 0
2x - 6 = 0
2x = +6
x = + 6
2
x = +3
Confrontando il NOX del ferro reagente (0) con il prodotto (+3), abbiamo osservato un aumento, cioè ha subito il processo di
ossidazione. Vale la pena notare che il verificarsi di ossidazione è sempre accompagnato dal fenomeno della riduzione (che significa guadagno di elettroni), identificato dalla diminuzione di NOx, come avviene nell'esempio con l'ossigeno.Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Leggi anche:Determinazione del numero di ossidazione (NOX)
Esempi di situazioni in cui si verifica l'ossidazione:
1. Combustione

La combustione di un materiale è anche indicativa di ossidazione.
Combustione è ogni reazione chimica che avviene in presenza di a carburante qualsiasi e il gas ossidante ossigeno (O2), con conseguente produzione di calore e luce. In ogni reazione di combustione si verifica ossidazione.
2. Alcune reazioni organiche
In ogni reazione organica che avviene in presenza dei mezzi di seguito elencati, il processo di ossidazione:
Dicromato di potassio (K2Cr2oh7) o permanganato di potassio (KMnO4);
Presenza di acido forte o base forte;
Ozono (O3) in presenza di zinco metallico (Zn) e acqua (H2O).
3. Batterie o batterie

Le batterie sono dispositivi in cui si verifica sempre l'ossidazione.
pile o le batterie sono dispositivi elettrochimici che immagazzinano sostanze chimiche. Una di queste sostanze subirà ossidazione e l'altra subirà riduzione, con conseguente produzione di corrente elettrica.
4. Elettrolisi
Elettrolisi è un processo chimico in cui una soluzione acquosa contenente un sale viene sottoposta a una corrente elettrica, che finisce per favorire l'ossidazione degli anioni presenti in questi materiali. In tutta l'elettrolisi, c'è ossidazione.
Di Me. Diogo Lopes Dias
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Aspetto:
GIORNI, Diogo Lopes. "Cos'è l'ossidazione?"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-oxidacao.htm. Consultato il 27 luglio 2021.

