Questa miscela di gas dà origine a miscele omogenee o soluzioni gassose. Ad esempio, i gas che escono dalle ciminiere delle fabbriche o dagli scarichi delle auto si diffondono nell'aria atmosferica e, con il passare del tempo, non siamo più riusciti a distinguerli, in quanto vi era una diffusione di questi gas attraverso il aria.

I gas emessi dai camini sono diffusi e “persi” nell'aria atmosferica, perché il volume dell'aria è molto maggiore di quello dei fumi.
| IL diffusione di un gas è un movimento spontaneo di un gas attraverso un altro, cioè la sua diffusione in un altro mezzo gassoso. |
| IL versamento di gas è un particolare tipo di diffusione, in cui vi è fuoriuscita di gas attraverso piccoli fori (o pareti porose, che è un insieme di piccoli fori). |
Ad esempio, i palloncini venduti ai bambini sono pieni di gas elio. Nel tempo, questo gas finisce per passare attraverso i pori di gomma del pallone, cioè c'è il suo versamento. Lo dimostra il fatto che il palloncino si sgonfia dopo poche ore.
Il chimico scozzese Thomas Graham, nel 1829, studiò questo comportamento dei gas. Ha concluso che la velocità con cui un gas si diffonde o si diffonde in un altro è correlata alla sua densità. Come i suoi dati sperimentali ripetuti per tutti i gas, ha creato la seguente legge che porta il suo nome:
Legge di Graham: la velocità di diffusione o effusione di un gas è inversamente proporzionale alla radice quadrata della sua densità.
Matematicamente, questa legge può essere espressa dall'equazione:
v α 
Oppure, mettendo in relazione due gas diversi, abbiamo:
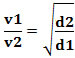
L'unità utilizzata in questo caso è il “volume che fuoriesce per unità di tempo”; quindi generalmente l/min (litri al minuto).
Pertanto, i gas con densità inferiore si diffondono più velocemente. Se è nelle stesse condizioni di temperatura e pressione, puoi anche fare una relazione di questo con la massa gas molare: maggiore è la densità del gas, maggiore è la sua massa molare e minore è la sua velocità di diffusione; e viceversa. Quindi, abbiamo:
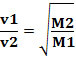
di Jennifer Fogaça
Laureato in Chimica
Squadra scolastica brasiliana
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/difusao-efusao-dos-gases.htm
