Le diverse sostanze che esistono nell'universo sono composte da atomi, ioni o molecole. Gli elementi chimici si combinano attraverso legami chimici. Questi link possono essere:
| Legame covalente | legame ionico | Connessione in metallo |
|---|---|---|
condivisione di elettroni |
trasferimento di elettroni |
Tra atomi di metallo |
Usa le domande seguenti per testare la tua conoscenza del legame chimico.
Esercizi proposti
domanda 1
Per interpretare le proprietà delle diverse sostanze è necessario conoscere i legami tra gli atomi ei legami tra le rispettive molecole. In relazione al legame tra atomi si può dire che...
(A) tra gli atomi legati predominano le forze di attrazione.
(B) quando si forma un legame tra atomi, il sistema formato raggiunge la massima energia.
(C) le attrazioni e le repulsioni in una molecola non sono solo di natura elettrostatica.
(D) tra gli atomi legati c'è un equilibrio tra attrazioni e repulsioni elettrostatiche.
Alternativa corretta: (D) Tra gli atomi legati c'è un equilibrio tra attrazioni e repulsioni elettrostatiche.
Gli atomi sono formati da cariche elettriche e sono le forze elettriche tra le particelle che portano alla formazione dei legami. Pertanto, tutti i legami chimici sono di natura elettrostatica.
Gli atomi hanno forze di:
- repulsione tra nuclei (cariche positive);
- repulsione tra elettroni (cariche negative);
- attrazione tra nuclei ed elettroni (cariche positive e negative).
In tutti i sistemi chimici, gli atomi cercano di diventare più stabili e questa stabilità si ottiene in un legame chimico.
La stabilità è dovuta all'equilibrio tra le forze di attrazione e repulsione, poiché gli atomi raggiungono uno stato di energia inferiore.
Domanda 2
Abbina correttamente le frasi nella colonna I e il tipo di collegamento nella colonna II.
| io | II |
|---|---|
| (A) Tra atomi di Na | 1. singolo legame covalente |
| (B) Tra atomi di Cl | 2. doppio legame covalente |
| (C) Tra atomi di O | 3. Connessione in metallo |
| (D) Tra N atomi | 4. legame ionico |
| (E) Tra gli atomi di Na e Cl | 5. triplo legame covalente |
Rispondere:
Atomi |
Tipi di connessione |
Rappresentazione |
(A) Tra atomi di Na |
Collegamento metallico. Gli atomi di questo metallo sono legati tra loro tramite legami metallici e l'interazione tra cariche positive e negative aumenta la stabilità dell'insieme. |
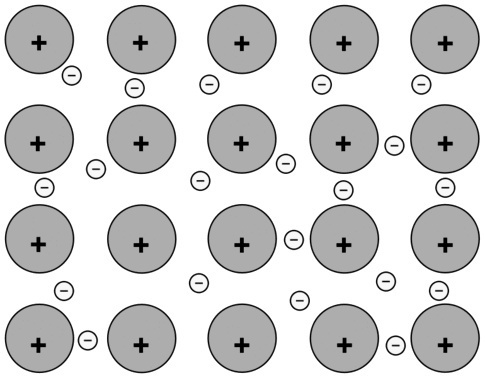 |
(B) Tra atomi di Cl |
Legame covalente singolo. La condivisione degli elettroni e la formazione di un singolo legame si verificano perché c'è solo una coppia di elettroni di legame. |
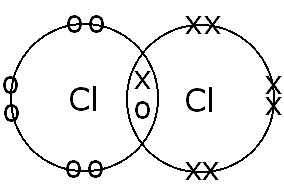 |
(C) Tra atomi di O |
Doppio legame covalente. Ci sono due coppie di elettroni di legame. |
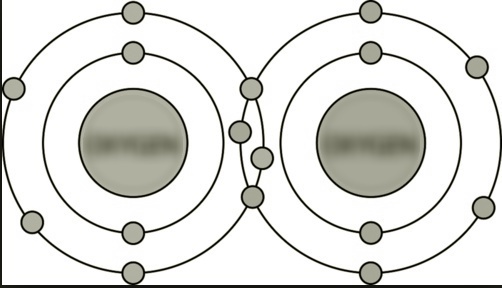 |
(D) Tra N atomi |
Triplo legame covalente. Ci sono tre coppie di elettroni di legame. |
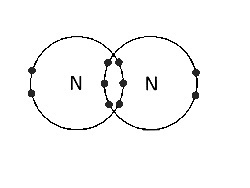 |
(E) Tra gli atomi di Na e Cl |
Legame ionico. Stabilito tra ioni positivi (cationi) e ioni negativi (anioni) attraverso il trasferimento di elettroni. |
 |
Domanda 3
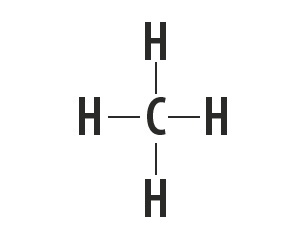
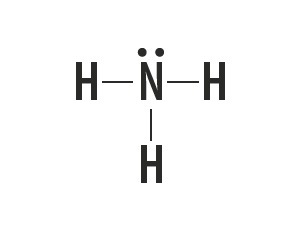
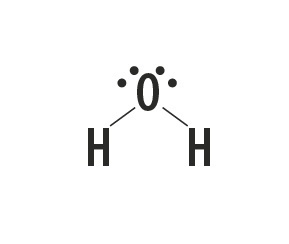
Metano, ammoniaca, acqua e acido fluoridrico sono sostanze molecolari le cui strutture di Lewis sono rappresentate nella tabella seguente.
| Metano, CH4 | ammoniaca, NH3 | Acqua, H2oh | acido fluoridrico, HF |
|---|---|---|---|
 |
 |
 |
 |
Indica il tipo di legame che si instaura tra gli atomi che compongono queste molecole.
Risposta corretta: legame covalente semplice.
Guardando la tavola periodica, vediamo che gli elementi delle sostanze non sono metalli.
Il tipo di legame che questi elementi formano tra di loro è il legame covalente, poiché condividono gli elettroni.
Gli atomi di carbonio, azoto, ossigeno e fluoro costituiscono otto elettroni nel guscio di valenza a causa del numero di legami che formano. Quindi obbediscono alla regola dell'ottetto.
L'idrogeno, invece, partecipa alla formazione delle sostanze molecolari condividendo una coppia di elettroni, stabilendo semplici legami covalenti.
Vedi anche: Legami chimici
domande esame di ammissione entrance
Le domande sui legami chimici compaiono spesso negli esami di ammissione all'università. Vedi sotto come l'argomento può essere affrontato.
domanda 1
(UEMG) Le proprietà esibite da un certo materiale possono essere spiegate dal tipo di legame chimico presente tra le sue unità formanti. In un'analisi di laboratorio, un chimico ha identificato le seguenti proprietà per un determinato materiale:
- Alta fusione e temperatura di ebollizione
- Buona conducibilità elettrica in soluzione acquosa
- Cattivo conduttore di elettricità allo stato solido
Dalle proprietà visualizzate da questo materiale, segnare l'alternativa che indica il tipo di connessione predominante in esso:
(A) metallico
(B) covalente
(C) dipolo indotto
(D) ionico
Alternativa corretta: (D) ionico.
Un materiale solido ha elevate temperature di fusione e di ebollizione, cioè avrebbe bisogno di molta energia per trasformarsi in uno stato liquido o gassoso.
Allo stato solido, il materiale è un cattivo conduttore di elettricità a causa dell'organizzazione degli atomi che formano una geometria ben definita.
A contatto con l'acqua compaiono degli ioni, che formano cationi e anioni, facilitando il passaggio della corrente elettrica.
Il tipo di legame che fa sì che il materiale abbia queste proprietà è il legame ionico.
Domanda 2
(PUC-SP) Analizzare le proprietà fisiche nella tabella seguente:
| Campione | Punto di fusione | Punto di ebollizione | Conducibilità elettrica a 25°C | Conducibilità elettrica a 1000 °C |
|---|---|---|---|---|
| IL | 801°C | 1413°C | isolante | conduttore |
| B | 43°C | 182 °C | isolante | |
| Ç | 1535 °C | 2760°C | conduttore | conduttore |
| D | 1248°C | 2250 °C | isolante | isolante |
Secondo i modelli del legame chimico, A, B, C e D possono essere classificati, rispettivamente, come,
(A) composto ionico, metallo, sostanza molecolare, metallo.
(B) metallo, composto ionico, composto ionico, sostanza molecolare.
(C) composto ionico, sostanza molecolare, metallo, metallo.
(D) sostanza molecolare, composto ionico, composto ionico, metallo.
(E) composto ionico, sostanza molecolare, metallo, composto ionico.
Alternativa corretta: (E) composto ionico, sostanza molecolare, metallo, composto ionico.
Analizzando gli stati fisici dei campioni quando sono sottoposti alle temperature presentate, dobbiamo:
| Campione | Stato fisico a 25°C | Stato fisico a 1000°C | Classificazione dei composti |
| IL | solido | liquido | Ionico |
| B | solido | Molecolare | |
| Ç | solido | solido | Metallo |
| D | solido | solido | Ionico |
Entrambi i composti A e D sono isolanti allo stato solido (a 25 ° C), ma quando il campione A passa allo stato liquido diventa conduttivo. Queste sono le caratteristiche dei composti ionici.
I composti ionici allo stato solido non consentono la conduttività a causa del modo in cui gli atomi si dispongono.
In soluzione, i composti ionici si trasformano in ioni e consentono di condurre l'elettricità.
È caratteristica dei metalli la loro buona conducibilità come il campione C.
I composti molecolari sono elettricamente neutri, cioè isolanti come il campione B.
Vedi anche: Collegamenti in metallo
Domanda 3
(Favest) Si consideri l'elemento cloro che forma composti con, rispettivamente, idrogeno, carbonio, sodio e calcio. Con quale di questi elementi il cloro forma composti covalenti?
Rispondere:
| Elementi | Come avviene la chiamata | legame formato | |
| cloro | Idrogeno | 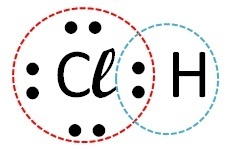 |
Covalente (condivisione di elettroni) |
| cloro | Carbonio | 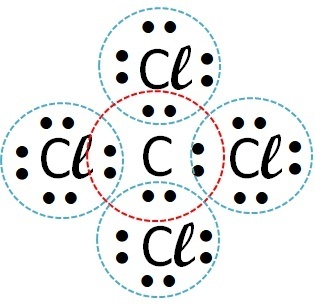 |
Covalente (condivisione di elettroni) |
| cloro | Sodio |  |
Ionico (trasferimento di elettroni) |
| cloro | Calcio | 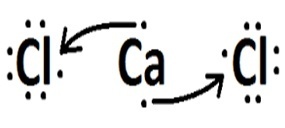 |
Ionico (trasferimento di elettroni) |
I composti covalenti si verificano nell'interazione di atomi non metallici, non metalli con idrogeno o tra due atomi di idrogeno.
Quindi il legame covalente avviene con cloro + idrogeno e cloro + carbonio.
Il sodio e il calcio sono metalli e si legano al cloro attraverso un legame ionico.
Domande sui nemici
L'approccio di Enem all'argomento potrebbe essere leggermente diverso da quello che abbiamo visto finora. Guarda come sono apparsi i legami chimici nel test del 2018 e scopri qualcosa in più su questo contenuto.
domanda 1
(Enem/2018) La ricerca mostra che i nanodispositivi basati su movimenti dimensionali atomici, indotti da leggero, può avere applicazioni nelle tecnologie future, sostituendo i micromotori, senza bisogno di componenti meccanica. Un esempio di movimento molecolare indotto dalla luce può essere visto piegando un sottile wafer di silicio, legato a un polimero azobenzenico e un materiale di supporto, in due lunghezze d'onda, come illustrato in figura. Con l'applicazione della luce si verificano reazioni reversibili della catena polimerica, che promuovono il movimento osservato.
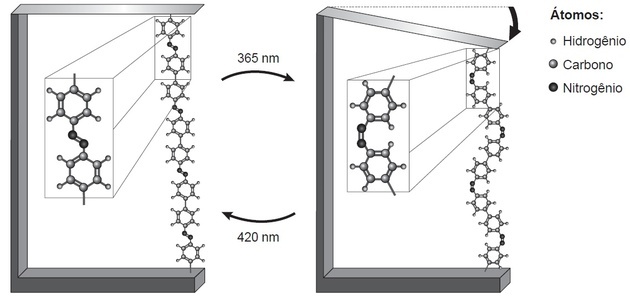
PRENDERE, H. E. Nanotecnologia delle molecole. Nuova Chimica a Scuola, n. 21 maggio 2005 (adattato).
Il fenomeno del movimento molecolare, promosso dall'incidenza della luce, deriva da (a)
(A) movimento vibrazionale degli atomi, che porta all'accorciamento e al rilassamento dei legami.
(B) isomerizzazione di legami N=N, la forma cis del polimero essendo più compatta di quella trans.
(C) tautomerizzazione delle unità monomeriche del polimero, che porta ad un composto più compatto.
(D) risonanza tra gli elettroni π del gruppo azo e quelli dell'anello aromatico che accorciano i doppi legami.
(E) variazione conformazionale di legami N=N che si traduce in strutture con diverse aree superficiali.
Alternativa corretta: (B) isomerizzazione di legami N=N, essendo la forma cis del polimero più compatta di quella trans.
Il movimento nella catena polimerica fa sì che si osservi un polimero più lungo a sinistra e uno più corto a destra.
Con la parte polimerica evidenziata, osserviamo due cose:
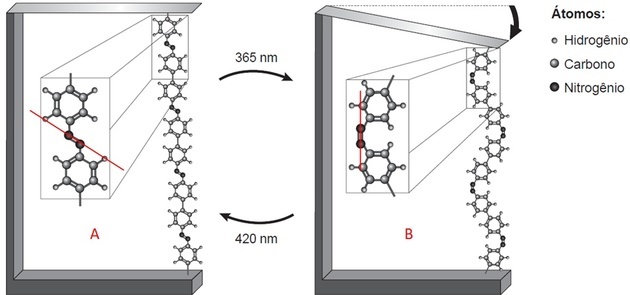
- Ci sono due strutture che sono legate da un legame tra due atomi (che la legenda indica come azoto);
- Questo collegamento è in posizioni diverse in ogni immagine.
Tracciando una linea sull'immagine, in A osserviamo che le strutture sono sopra e sotto l'asse, cioè lati opposti. In B, sono dalla stessa parte della linea tracciata.
L'azoto rende stabili tre legami. Se è legato alla struttura da un legame, allora è legato all'altro azoto tramite un doppio legame covalente.
La compattazione del polimero e la flessione della lama si verificano perché i leganti si trovano in posizioni diverse quando si verifica l'isomerismo dei legami N=N.
L'isomerismo trans si osserva in A (linker sui lati opposti) e cis in B (linker sullo stesso piano).
Domanda 2
(Enem/2018) Alcuni materiali solidi sono composti da atomi che interagiscono tra loro formando legami che possono essere covalenti, ionici o metallici. La figura mostra l'energia potenziale di legame in funzione della distanza interatomica in un solido cristallino. Analizzando questa figura si osserva che, alla temperatura di zero kelvin, la distanza di equilibrio del legame tra gli atomi (R0) corrisponde al valore minimo dell'energia potenziale. Al di sopra di tale temperatura, l'energia termica fornita agli atomi aumenta la loro energia cinetica e provoca oscillano attorno a una posizione di equilibrio media (cerchi pieni), che è diversa per ciascuno temperatura. La distanza di collegamento può variare su tutta la lunghezza delle linee orizzontali, identificate con il valore di temperatura di T1 il T4 (aumento delle temperature).

Lo spostamento osservato nella distanza media rivela il fenomeno di
(A) ionizzazione.
(B) dilatazione.
(C) dissociazione.
(D) rottura di legami covalenti.
(E) formazione di legami metallici.
Alternativa corretta: (B) dilatazione.
Gli atomi hanno cariche positive e negative. I legami si formano quando raggiungono un'energia minima bilanciando le forze (repulsione e attrazione) tra gli atomi.
Da questo si capisce che: perché si verifichi un legame chimico c'è una distanza ideale tra gli atomi in modo che siano stabili.
Il grafico mostrato ci mostra che:
- La distanza tra due atomi (interatomica) diminuisce fino a raggiungere un'energia minima.
- L'energia può aumentare quando gli atomi si avvicinano così tanto che le cariche positive nei loro nuclei si avvicinano, iniziano a respingersi a vicenda e di conseguenza aumentano l'energia.
- Alla temperatura T0 di zero Kelvin è il valore minimo dell'energia potenziale.
- Si ha un aumento della temperatura di T1 a T4 e l'energia fornita fa oscillare gli atomi attorno alla posizione di equilibrio (cerchi pieni).
- L'oscillazione avviene tra la curva e il cerchio completo corrispondente a ciascuna temperatura.
Poiché la temperatura misura il grado di agitazione delle molecole, maggiore è la temperatura, più l'atomo oscilla e lo spazio da esso occupato aumenta.
La temperatura più alta (T4) indica che ci sarà uno spazio maggiore occupato da quel gruppo di atomi e quindi il materiale si espande.
Domanda 3
(Enem/2019) Perché hanno uno strato di valenza completo, alta energia di ionizzazione e affinità elettronica praticamente nullo, per lungo tempo si è ritenuto che i gas nobili non formassero composti sostanze chimiche. Tuttavia, nel 1962, la reazione tra lo xeno (5s²5p layer strato di valenza) e l'esafluoruro di platino è stata condotta con successo e, da allora, sono stati sintetizzati più nuovi composti di gas nobili.
Tali composti dimostrano che non si può accettare acriticamente la regola dell'ottetto, in cui si ritiene che, in un legame chimico gli atomi tendono ad acquisire stabilità assumendo la configurazione elettronica del gas nobile. Tra i composti noti, uno dei più stabili è il difluoruro di xeno, in cui due atomi di alogeno il fluoro (2s²2p⁵ strato di valenza) si lega covalentemente all'atomo di gas nobile per avere otto elettroni di valenza.
Quando si scrive la formula di Lewis per il suddetto composto di xeno, quanti elettroni ci sono nel guscio di valenza nell'atomo di gas nobile?
(LA) 6
(B) 8
(Do) 10
(D) 12
Alternativa corretta: c) 10.
Il fluoro è un elemento che fa parte del gruppo 17 della tavola periodica. Pertanto, nel suo guscio elettronico più esterno ci sono 7 elettroni (2s2 2p5). Per acquisire stabilità, secondo la regola dell'ottetto, l'atomo di questo elemento ha bisogno di un elettrone per avere così 8 elettroni nel guscio di valenza e assumere la configurazione elettronica di un gas nobile.
Lo xeno, invece, è un gas nobile, e quindi ha già 8 elettroni nell'ultimo strato (5s2 5p6).
Si noti che il nome del composto è difluoruro di xeno, cioè il composto è composto da due atomi di fluoro e un atomo di xeno, XeF2.
Come dice l'affermazione, il legame chimico tra gli atomi è di tipo covalente, cioè c'è la condivisione di elettroni.
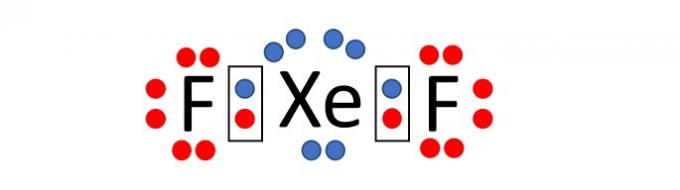
Distribuendo gli elettroni attorno a ciascun atomo (7 attorno al fluoro e 8 attorno allo xeno) vediamo che l'atomo di xeno, quando si lega con due atomi di fluoro, ha 10 elettroni nel guscio di fluoro. valenza.
Vedi anche:
- regola dell'ottetto
- Esercizi sulla distribuzione elettronica
- Esercizi sugli idrocarburi
