Le funzioni inorganiche sono gruppi di composti inorganici che hanno caratteristiche simili.
Una classificazione fondamentale in relazione ai composti chimici è: i composti organici sono quelli che contengono atomi di carbonio, mentre i composti organici contengono atomi di carbonio. composti inorganici sono formati da altri elementi chimici.
Ci sono eccezioni come CO, CO2 e via2CO3, che pur avendo carbonio nella formula strutturale, hanno caratteristiche di sostanze inorganiche.
Le quattro principali funzioni inorganiche sono: acidi, basi, sali e ossidi.
Queste 4 funzioni principali sono state definite da Arrhenius, un chimico che identificò gli ioni negli acidi, nelle basi e nei sali.
Acidi
Acidi sono composti covalenti, cioè condividono gli elettroni nei loro legami. Hanno la capacità di ionizzare in acqua e formare cariche, rilasciando H+ come unico catione.
Classificazione degli acidi
Gli acidi possono essere classificati in base alla quantità di idrogeno che viene rilasciato in una soluzione acquosa e si ionizzano, reagendo con l'acqua per formare lo ione idronio.
| Numero di idrogeni ionizzabili |
|---|
|
Monoacidi: hanno un solo idrogeno ionizzabile. Esempi: HNO3, HCl e HCN |
|
diacidi: hanno due idrogeni ionizzabili. Esempi: H2SOLO4, H2S e H2MnO4 |
|
triacidi: hanno tre idrogeni ionizzabili. Esempi: H3POLVERE4 e H3BO3 |
|
tetracidi: hanno quattro idrogeni ionizzabili. Esempi: H4P7oh7 |
La forza di un acido è misurata dal grado di ionizzazione. Maggiore è il valore di più forte è l'acido perché:
| grado di ionizzazione |
|---|
|
forte: hanno un grado di ionizzazione maggiore del 50%. |
|
moderare: hanno un grado di ionizzazione compreso tra il 5% e il 50%. |
|
debole: hanno un grado di ionizzazione inferiore al 5%. |
Gli acidi possono o meno contenere l'elemento ossigeno nella loro struttura, quindi:
| presenza di ossigeno |
|---|
|
Idracidi: non hanno atomi di ossigeno. Esempi: HCl, HBr e HCN. |
|
ossiacidi: L'elemento ossigeno è presente nella struttura acida. Esempi: HClO, H2CO3 e HNO3. |
nomenclatura degli acidi
La formula generale di un acido può essere descritta come HXIL, dove A rappresenta l'anione che compone l'acido e la nomenclatura generata può essere:
| terminazione anionica | Terminazione acida |
|---|---|
|
eto Esempio: Cloruro (Cl-) |
idrica Esempio: acido cloridrico (HCl) |
|
atto Esempio: clorato |
io Esempio: acido clorico (HClO3) |
|
molto Esempio: nitrito |
osso Esempio: acido nitroso (HNO2) |
Caratteristiche degli acidi
Le principali caratteristiche degli acidi sono:
- Hanno un sapore acido.
- Trasportano corrente elettrica, poiché sono soluzioni elettrolitiche.
- Formano idrogeno quando reagiscono con metalli come magnesio e zinco.
- Forma anidride carbonica quando reagisce con il carbonato di calcio.
- Cambiano gli indicatori acido-base in un colore specifico (la cartina tornasole blu diventa rossa).
Acidi principali
Esempi: acido cloridrico (HCl), acido solforico (H2SOLO4), acido acetico (CH3COOH), acido carbonico (H2CO3) e acido nitrico (HNO3).
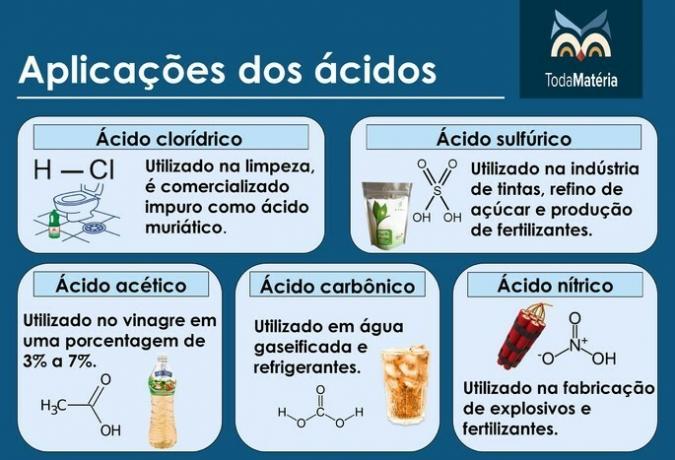
Sebbene l'acido acetico sia un acido della chimica organica, è importante conoscerne la struttura a causa della sua importanza.
basi
basi sono composti ionici formati da cationi, per lo più metalli, che si dissociano in acqua liberando l'anione idrossido (OH-).
Classificazione di base
Le basi possono essere classificate in base al numero di ossidrili rilasciati in soluzione.
| Numero di ossidrili |
|---|
|
Monobasi: hanno un solo ossidrile. Esempi: NaOH, KOH e NH4Oh |
|
dibasi: hanno due ossidrili. Esempi: Ca(OH)2, Fe(OH)2 e Mg(OH)2 |
|
Tribasi: hanno tre ossidrili. Esempi: Al(OH)3 e Fe(OH)3 |
|
tetrabasi: hanno quattro ossidrili. Esempi: Sn(OH)4 e Pb(OH)4 |
Le basi sono generalmente sostanze ioniche e la forza di una base è misurata dal grado di dissociazione.
Maggiore è il valore di più forte è la base perché:
| grado di dissociazione |
|---|
|
forte: hanno un grado di dissociazione praticamente del 100%. Esempi:
|
|
debole: hanno un grado di dissociazione inferiore al 5%. Esempio: NH4OH e Zn(OH)2. |
| solubilità in acqua |
|---|
|
Solubile: basi di metalli alcalini e ammonio. Esempi: Ca(OH)2, Ba(OH)2 e NH4Oh. |
|
Leggermente solubile: basi di metalli alcalino terrosi. Esempi: Ca(OH)2 e Ba(OH)2. |
|
praticamente insolubile: altre basi. Esempi: AgOH e Al(OH)3. |
nomenclatura di base
La formula generale di una base può essere descritta come , dove B rappresenta il radicale positivo che costituisce la base e y è la carica che determina il numero di ossidrili.
La nomenclatura per le basi a carico fisso è data da:
| Basi con carico fisso | ||
|---|---|---|
metalli alcalini |
idrossido di litio |
LiOH |
| Metalli alcalino-terrosi | idrossido di magnesio |
mg(OH)2 |
Argento |
idrossido d'argento |
AgOH |
| Zinco | idrossido di zinco | Zn(OH)2 |
| Alluminio | idrossido di alluminio | Al(OH)3 |
Quando la base ha un carico variabile, la nomenclatura può essere in due modi:
| Basi a carico variabile | |||
|---|---|---|---|
| Rame | Culo+ | idrossido di rame I | CuOH |
| idrossido rameoso | |||
| Culo2+ | idrossido di rame II | Cu(OH)2 | |
| idrossido rameico | |||
| Ferro | Fede2+ | Idrossido di ferro II | Fe(OH)2 |
| idrossido ferroso | |||
| Fede3+ | Idrossido di ferro III | Fe(OH)3 | |
| idrossido ferrico |
Caratteristiche delle basi
- La maggior parte delle basi sono insolubili in acqua.
- Condurre corrente elettrica in soluzione acquosa.
- Sono scivolosi.
- Reagiscono con l'acido per formare sale e acqua come prodotti.
- Cambiano gli indicatori acido-base in un colore specifico (la cartina di tornasole rossa diventa blu).
Basi principali
Le basi sono ampiamente utilizzate nei prodotti per la pulizia e anche nei processi dell'industria chimica.
Esempi: idrossido di sodio (NaOH), idrossido di magnesio (Mg (OH)2), idrossido di ammonio (NH4OH), idrossido di alluminio (Al(OH)3) e idrossido di calcio (Ca(OH)2).

sali
sali sono composti ionici che hanno almeno un catione diverso da H+ e un anione diverso da OH-.
Un sale può essere ottenuto in una reazione di neutralizzazione, che è la reazione tra un acido e una base.
La reazione dell'acido cloridrico con l'idrossido di sodio produce cloruro di sodio e acqua.
Il sale formato è composto dall'anione acido (Cl-) e dal catione base (Na+).
Classificazione dei sali
Di seguito, abbiamo le principali famiglie di sali che possono essere classificate in base alla solubilità in acqua e al cambiamento di pH della soluzione come segue:
| Idrosolubilità dei sali più comuni | |||
|---|---|---|---|
| Solubile | Nitrati | Eccezioni: Acetato d'argento. |
|
| Clorati | |||
acetati |
|||
| Cloruri | Eccezioni: |
||
| bromuri | |||
| ioduri | |||
| solfati |
Eccezioni: |
||
| Insolubile | solfuri |
Eccezioni: terre alcaline e ammonio. |
|
| carbonati | Eccezioni: Quelli dei metalli alcalini e dell'ammonio. |
||
| fosfati |
| pH | |
|---|---|
| sali neutri |
Sciolti in acqua non cambiano il pH. Esempio: NaCl. |
| sali acidi |
Quando vengono sciolti in acqua rendono la soluzione a pH inferiore a 7. Esempio: NH4cl. |
| sali basici |
Quando si sciolgono in acqua rendono la soluzione a pH maggiore di 7. Esempio: CH3COONa. |
Oltre alle famiglie di sale che abbiamo visto in precedenza, esistono altri tipi di sali, come mostrato nella tabella sottostante.
| Altri tipi di sali | |
|---|---|
| sali di idrogeno | Esempio: NaHCO3 |
| Idrossi-sali | Esempio: Al(OH)2Cl |
| sali doppi | Esempio: KNaSO4 |
| sali idratati | Esempio: CuSO4. 5 ore2oh |
| sali complessi | Esempio: [Cu (NH3)4]SOLO4 |
Nomenclatura dei sali
In generale, la nomenclatura di un sale segue il seguente ordine:
| nome dell'anione | nome cazione | nome di sale |
|---|---|---|
|
Cl- Cloruro |
Fede3+ Ferro III |
FeCl3 Cloruro di ferro III |
|
Solfato |
A+ Sodio |
A2SOLO4 Solfato di sodio |
|
Nitrito |
K+ Potassio |
SAPERE2 Nitrito di potassio |
|
fratello- Bromuro |
Qui2+ Calcio |
CaBr2 bromuro di calcio |
Caratteristiche dei sali
- Sono composti ionici.
- Sono solidi e cristallini.
- Soffre di ebollizione ad alte temperature.
- Condurre corrente elettrica in soluzione.
- Hanno un sapore salato.
sali principali
Esempi: nitrato di potassio (KNO3), ipoclorito di sodio (NaClO), fluoruro di sodio (NaF), carbonato di sodio (Na2CO3) e solfato di calcio (CaSO4).

ossidi
ossidi sono composti binari (ionici o molecolari) che hanno due elementi. Hanno ossigeno nella loro composizione, che è il loro elemento più elettronegativo.
La formula generale per un ossido è , dove C è il catione e la sua carica y diventa un indice nell'ossido che forma il composto:
Classificazione degli ossidi
| Secondo i legami chimici | |
|---|---|
| Ionico |
Combinazione di ossigeno con metalli. Esempio: ZnO. |
| Molecolare |
Combinazione di ossigeno con elementi non metallici. Esempio: OS2. |
| Secondo le proprietà | |
|---|---|
| Nozioni di base |
In soluzione acquosa cambiano il pH a maggiore di 7. Esempio: ho letto2O (e altri metalli alcalini e alcalino terrosi). |
| Acidi |
In soluzione acquosa reagiscono con l'acqua e formano acidi. Esempi: CO2, SOLO3 e NO2. |
| neutri |
Alcuni ossidi che non reagiscono con l'acqua. Esempio: CO. |
| perossidi |
In soluzione acquosa reagiscono con acqua o acidi diluiti e formano acqua ossigenata H2oh2. Esempio: Na2oh2. |
| anfoter |
Possono comportarsi come acidi o basi. Esempio: ZnO. |
Nomenclatura degli ossidi
In generale, la nomenclatura di un ossido segue il seguente ordine:
| Nome in base al tipo di ossido | |
|---|---|
| ossidi ionici |
Esempi di ossidi a carica fissa: CaO - ossido di calcio Al2oh3 - ossido di alluminio |
|
Esempi di ossidi a carica variabile: FeO - Ossido di ferro II Fede2oh3 - Ossido di ferro III | |
| ossidi molecolari |
Esempi: CO - monossido di carbonio no2oh5 - Pentossido di diazoto |
Caratteristiche dell'ossido
- Sono sostanze binarie.
- Sono formati dal legame dell'ossigeno con altri elementi, ad eccezione del fluoro.
- Gli ossidi metallici, quando reagiscono con gli acidi, formano sale e acqua.
- Gli ossidi non metallici, reagendo con le basi, formano sale e acqua.
Principali ossidi
Esempi: ossido di calcio (CaO), ossido di manganese (MnO2), ossido di stagno (SnO2), ossido di ferro III (Fe2oh3) e ossido di alluminio (Al2CO3).

Esercizi per l'esame di ammissione
1. (UEMA/2015) NO2e il sistema operativo2 sono gas che provocano inquinamento atmosferico che, tra i danni provocati, determinano la formazione di di piogge acide quando questi gas reagiscono con le particelle d'acqua presenti nelle nuvole, producendo HNO3 e H2SOLO4.
Questi composti, se veicolati dalle precipitazioni atmosferiche, generano disturbi, quali contaminazione dell'acqua potabile, corrosione di veicoli, monumenti storici, ecc.
I composti inorganici citati nel testo corrispondono, rispettivamente, alle funzioni:
a) sali e ossidi
b) basi e sali
c) acidi e basi
d) basi e ossidi
e) ossidi e acidi
Alternativa corretta: e) ossidi e acidi.
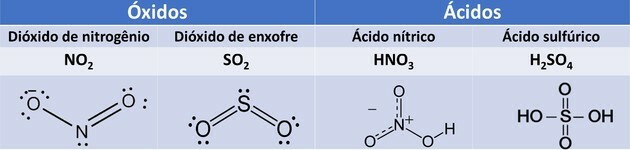
Gli ossidi sono composti formati da ossigeno e altri elementi, ad eccezione del fluoro.
Gli acidi, quando entrano in contatto con l'acqua, vanno incontro a ionizzazione e producono lo ione idronio. Per gli acidi in questione si hanno le seguenti reazioni:
l'HNO3 è monoacido perché ha un solo idrogeno ionizzabile. l'H2SOLO4 è un diacido perché ha due idrogeni ionizzabili.
Le altre funzioni inorganiche presenti nelle domande corrispondono a:
Basi: ioni ossidrile (OH-) legato ionicamente con cationi metallici.
Sali: prodotto della reazione di neutralizzazione tra un acido e una base.
Impara di più riguardofunzioni chimiche.
2. (UNEMAT/2012) Nella nostra vita quotidiana utilizziamo vari prodotti chimici, come latte di magnesio, aceto, calcare e soda caustica.
È corretto affermare che queste sostanze citate appartengono, rispettivamente, alle funzioni chimiche:
a) acido, base, sale e base
b) base, sale, acido e base
c) base, acido, sale e base
d) acido, base, base e sale
e) sale, acido, sale e base
Alternativa corretta: c) base, acido, sale e base.
Latte di magnesio, calcare e soda caustica sono esempi di composti che contengono funzioni inorganiche nelle loro strutture.
L'aceto è un composto organico formato da un acido carbossilico debole.
Nella tabella sottostante possiamo osservare le strutture di ciascuno di essi e le funzioni chimiche che li caratterizzano.
| Prodotto | Latte al magnesio | Aceto | Calcare | Soda caustica |
|---|---|---|---|---|
| Composto chimico | idrossido di magnesio | Acido acetico | Carbonato di calcio | Idrossido di sodio |
| Formula | ||||
| funzione chimica | Base | acido carbossilico | sale | Base |
Il latte di magnesio è una sospensione di idrossido di magnesio utilizzata per trattare l'acidità di stomaco, poiché reagisce con l'acido cloridrico del succo gastrico.
L'aceto è un condimento ampiamente utilizzato principalmente nella preparazione dei cibi per il suo aroma e sapore.
Il calcare è una roccia sedimentaria, il cui minerale principale è la calcite, che contiene grandi quantità di carbonato di calcio.
La soda caustica è il nome commerciale dell'idrossido di sodio, una base forte utilizzata in molti processi industriali e nell'uso domestico per sbloccare i tubi a causa di un accumulo di oli e grassi.
3. (UDESC/2008) Per quanto riguarda l'acido cloridrico si può affermare che:
a) in soluzione acquosa, permette il passaggio di corrente elettrica
b) è un diacido
c) è un acido debole
d) ha un basso grado di ionizzazione
e) è una sostanza ionica
Alternativa corretta: a) in soluzione acquosa, permette il passaggio di corrente elettrica.
L'acido cloridrico è un monoacido in quanto contiene un solo idrogeno ionizzabile.
È un composto molecolare, con un alto grado di ionizzazione e quindi è un acido forte, che entrando in contratto con l'acqua, rompe la sua molecola in ioni come segue:
Come osservò Arrhenius nei suoi esperimenti, gli ioni positivi formati nella ionizzazione si spostano verso il polo negativo, mentre gli ioni negativi si spostano verso il polo positivo.
In questo modo, la corrente elettrica fluisce nella soluzione.
Per ulteriori problemi con la risoluzione commentata, vedere anche: esercizi sulle funzioni inorganiche.