Gli esperimenti sono un modo pratico per apprendere e mettere alla prova la tua conoscenza dei concetti studiati in Chimica.
Approfitta di questi esperimenti chimici, che possono essere fatti a casa (sotto la supervisione di un adulto) o lavorati in classe con l'insegnante, per completare i tuoi studi.
1a esperienza - svelare i colori
Concetti coinvolti: cromatografia e separazione di miscele
Materiali
- penne (marcatori) di vari colori
- alcol
- carta da filtro per caffè
- tazza (vetro per facilitare il monitoraggio dell'esperimento)
Come fare
- Usa le forbici e taglia delle strisce di carta da filtro. Per ogni penna utilizzata, crea un rettangolo.
- Ora, a una distanza di circa 2 cm dalla base, disegna un cerchio con la penna del colore scelto e dipingi tutto l'interno.
- Incolla il bordo della carta più lontano dal marmo disegnato su un supporto. Per questo, puoi usare un nastro e attaccarlo a una matita.
- Aggiungi dell'alcol nella tazza, non troppo, poiché dovrebbe appena toccare l'estremità della carta vicino al segno della penna.
- Metti la carta nella tazza in modo che sia verticale. La matita che lo sostiene dovrebbe essere appoggiata sui bordi.
- Attendere dai 10 ai 15 minuti affinché l'alcol salga attraverso la carta da filtro. Dopodiché, rimuovi i fogli e lasciali asciugare.
Risultato
Quando l'alcol passa attraverso il segno della penna, interagisce con i componenti del colore e li guida attraverso la carta. Pertanto, i diversi pigmenti verranno separati dal contatto con l'alcol.
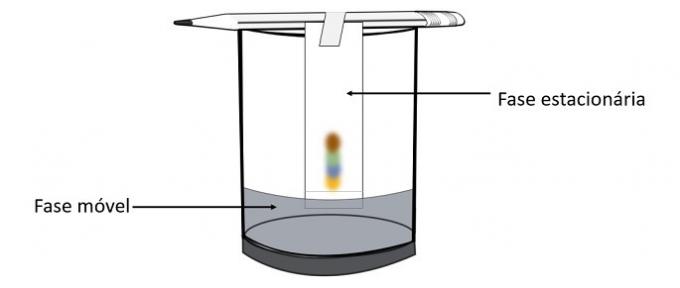
Attraverso questo esperimento è possibile sapere quali colori sono stati miscelati per creare il colore della penna.
Spiegazione
La cromatografia è un tipo di processo per separare le miscele. La carta da filtro è la fase stazionaria e l'alcol è la fase mobile che trascina i componenti della miscela mentre attraversa la fase stazionaria. In questo processo, maggiore è l'interazione con l'alcol, più velocemente si muoverà il pigmento al passaggio del solvente.
I costituenti del materiale, avendo proprietà diverse, interagiranno con la fase mobile in modi diversi, che si possono notare dai diversi tempi di trascinamento nella fase stazionaria.
Impara di più riguardo cromatografia.
2a esperienza - conservazione degli alimenti
Concetti coinvolti: composti organici e reazioni chimiche
Materiali
- mela, banana o pera
- succo di limone o arancia
- Compressa di vitamina C
Come fare
- Scegli uno dei tre frutti e taglialo in 3 parti uguali.
- Il primo pezzo servirà da confronto con gli altri. Quindi non aggiungere nulla, lascialo esposto all'aria.
- In uno dei pezzi, gocciolare il contenuto di un limone o di un'arancia. Stendere in modo che l'intero interno del frutto sia ricoperto di succo.
- Nell'ultima parte spargete la vitamina C, può essere una compressa schiacciata, su tutta la polpa del frutto.
- Guarda cosa succede e confronta i risultati.
Risultato
La polpa del frutto che è stata esposta all'aria dovrebbe scurirsi rapidamente. Il succo di limone o arancia e la vitamina C, una sostanza chimica chiamata acido ascorbico, dovrebbero rallentare la doratura del frutto.

Spiegazione
Quando tagliamo un frutto, le sue cellule vengono danneggiate rilasciando enzimi come la polifenolo ossidasi, che in il contatto con l'aria ossida i composti fenolici presenti negli alimenti e provoca un imbrunimento enzimatico.
Per prevenire l'azione dell'ossigeno si utilizzano conservanti come l'acido ascorbico perché vengono preferibilmente ossidati al posto dei composti fenolici. Oltre alla compressa di vitamina C, l'acido ascorbico è presente anche in fonti naturali, come agrumi, limone e arancia, suggerite nell'esperimento.
Impara di più riguardo ossidazione.
3a esperienza: chi si congela più velocemente?
Concetti coinvolti: proprietà colligative e crioscopia
Materiali
- due tubi (usati per le bomboniere)
- ciotola di vetro
- sale da tavola
- acqua filtrata
- ghiaccio
- termometro
Come fare
- Aggiungere la stessa quantità di acqua filtrata in entrambi i tubi. Ad esempio, 5 ml in ogni provetta.
- Aggiungi il sale da cucina a uno dei tubi e posiziona un nastro di identificazione per distinguere quale è salato.
- Riempi il contenitore di vetro con ghiaccio tritato e aggiungi un po' di sale.
- Metti i due tubi contemporaneamente nel ghiaccio e osserva cosa succede.
- Registra la temperatura di congelamento per ogni situazione.
Risultato
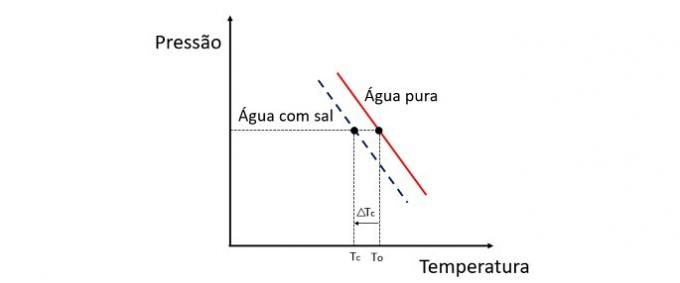
L'aggiunta di un soluto all'acqua abbassa la temperatura di congelamento. Pertanto, l'acqua semplice tende a congelare molto più velocemente di una soluzione di acqua e sale se esposta alle stesse condizioni.
Spiegazione
La crioscopia è una proprietà colligativa che studia la variazione della temperatura di un solvente quando in esso vengono disciolte diverse quantità di soluto.
L'abbassamento della temperatura di congelamento dell'acqua è causato da un soluto non volatile e questo fenomeno ha molte applicazioni pratiche. Pertanto, maggiore è la concentrazione di soluto nella soluzione influenza l'effetto crioscopico.
Se, ad esempio, l'acqua gela a 0 °C e vi aggiungiamo del sale, la temperatura di cambio di fase sarà negativa, cioè molto più bassa.
Ecco perché l'acqua di mare non gela nei luoghi la cui temperatura è inferiore a 0°C. Il sale sciolto in acqua tende ad abbassare ulteriormente la temperatura di congelamento. Nei luoghi dove c'è la neve, è anche comune gettare sale sulle strade per sciogliere il ghiaccio ed evitare incidenti.
Impara di più riguardo proprietà colligative.
4° esperimento - decomposizione del perossido di idrogeno
concetti coinvolti: reazione chimica e catalizzatore
Materiali
- Mezza patata cruda e metà cotta
- Un pezzo di fegato crudo e un altro pezzo cotto
- Perossido di idrogeno
- 2 piatti
Come fare
- In ogni piatto aggiungete il cibo, le patate insieme e i fegatini insieme.
- In ciascuno dei quattro materiali aggiungere 3 gocce di perossido di idrogeno.
- Guarda cosa succede e confronta i risultati.
Risultato
Il perossido di idrogeno, una soluzione di perossido di idrogeno, quando entra in contatto con cibi crudi, inizia a effervescenza quasi istantaneamente.
Questo esperimento può essere fatto anche aggiungendo un pezzo di cibo in un contenitore con acqua ossigenata per rendere più evidente la reazione.
Spiegazione
L'effervescenza presentata dall'acqua ossigenata a contatto con cibi crudi caratterizza il verificarsi di una reazione chimica, che è la decomposizione del perossido di idrogeno e il rilascio del gas ossigeno.
La decomposizione del perossido di idrogeno avviene per azione dell'enzima catalasi, presente negli organelli dei perossisomi, presenti nelle cellule animali e vegetali.
È importante evidenziare che la decomposizione dell'acqua ossigenata avviene spontaneamente, in presenza di luce solare, ma con una reazione molto lenta. Tuttavia, la catalasi agisce come catalizzatore, aumentando la velocità della reazione chimica.
Il perossido di idrogeno può essere una sostanza tossica per le cellule. Pertanto, la catalasi scompone il composto e produce acqua e ossigeno, due sostanze che non danneggiano l'organismo.
Quando il cibo viene cotto, i suoi componenti subiscono dei cambiamenti. Le modificazioni causate dalla cottura compromettono anche l'azione della catalasi denaturando la proteina.
La stessa azione che vediamo con il cibo è ciò che accade quando mettiamo il perossido di idrogeno su una ferita. Agisce la catalasi e si ha la formazione di bolle, che consiste nel rilascio di ossigeno.
Impara di più riguardo reazioni chimiche.
Riferimenti bibliografici
SANTI, W. l. p.; MOL, G. S. (Coordinate.). Chimica dei cittadini. 1. ed. San Paolo: nuova generazione, 2011. v. 1, 2, 3.
SOCIETÀ CHIMICA BRASILIANA (org.) 2010. Chimica vicino a te: esperimenti a basso costo per l'aula K-12. 1. ed. San Paolo.