L'equilibrio chimico è una delle materie che più rientrano negli Enem e negli esami di ammissione.
Nelle domande vengono affrontati gli aspetti delle reazioni reversibili ei candidati vengono valutati sia dai calcoli che dai concetti che coinvolgono questo tema.
Con questo in mente, abbiamo creato questo elenco di domande con diversi approcci all'equilibrio chimico.
Approfitta dei commenti sulla risoluzione per prepararti agli esami e controlla le istruzioni passo passo su come risolvere le domande.
Concetti generali di equilibrio chimico
1. (Uema) Nell'equazione , dopo aver raggiunto l'equilibrio chimico, possiamo concludere la costante di equilibrio
, in merito al quale è corretto affermare che:
a) maggiore è il valore di Kc, minore è la resa della reazione diretta.
b) Kç indipendentemente dalla temperatura.
c) se le velocità delle reazioni diretta e inversa sono uguali, allora Kc = 0.
d) Kç dipende dalle molarità iniziali dei reagenti.
e) maggiore è il valore di Kc, maggiore è la concentrazione dei prodotti.
Risposta corretta: e) maggiore è il valore di Kc, maggiore è la concentrazione dei prodotti.
La reazione diretta è rappresentata dal numero 1, dove:
La reazione inversa è rappresentata da
Il valore di Kç è calcolato dal rapporto tra le concentrazioni dei prodotti e dei reagenti.
Il numeratore (che contiene i prodotti) è direttamente proporzionale alla costante di equilibrio. Pertanto, maggiore è il valore di Kç, tanto maggiore è la resa della reazione diretta, quanto più prodotto si sta formando e, di conseguenza, maggiore è la concentrazione dei prodotti.
Il valore di Kç varia con la temperatura, perché quando ne cambiamo il valore, la reazione endotermica (assorbimento di calore) o esotermica (rilascio di calore) può essere favorito e, con questo, si può consumare o creare più reagente o prodotto, modificando così la costante di equilibrio che dipende dalla concentrazione di reagenti.
Kc dipende dalle quantità molari dei componenti quando si stabilisce l'equilibrio e quando le velocità delle reazioni diretta e inversa sono uguali.
2. (UFRN) L'equilibrio chimico è caratterizzato dall'essere dinamico a livello microscopico. Per ottenere informazioni quantitative sull'entità dell'equilibrio chimico, viene utilizzata la quantità costante di equilibrio. Considera la seguente striscia:

Applicato all'equilibrio chimico, l'idea di equilibrio del personaggio:
a) È corretto perché, in equilibrio chimico, metà delle quantità sono sempre prodotti, e l'altra metà sono reagenti.
b) Non è corretto, poiché, in equilibrio chimico, le concentrazioni dei prodotti e quelle dei reagenti possono essere diverse, ma sono costanti.
c) È corretto perché, in equilibrio chimico, le concentrazioni di reagenti e prodotti sono sempre le stesse, purché l'equilibrio non sia disturbato da un effetto esterno.
d) Non è corretto, in quanto, in equilibrio chimico, le concentrazioni dei prodotti sono sempre superiori a quelle dei reagenti, purché l'equilibrio non sia influenzato da un fattore esterno.
e) È corretto perché, in equilibrio chimico, le concentrazioni di reagenti e prodotti non sono sempre le stesse.
Risposta corretta: b) Non è corretta, poiché, in equilibrio chimico, le concentrazioni dei prodotti e quelle dei reagenti possono essere diverse, ma sono costanti.
All'equilibrio, le quantità di prodotti e reagenti possono essere calcolate in base alla costante di equilibrio, e non necessariamente dovrebbe essere metà della quantità di prodotti e l'altra metà reagenti.
Le concentrazioni di equilibrio non sono sempre le stesse, possono essere diverse, ma costanti se non si verificano disturbi nell'equilibrio.
Le concentrazioni di equilibrio dovrebbero dipendere da quale reazione viene favorita, diretta o inversa. Possiamo conoscerlo dal valore di Kç: se Kç 1, la reazione diretta è favorita. già se Kç
1 è favorita la reazione inversa.
Grafici dell'equilibrio chimico
3. (UFPE) All'inizio del XX secolo, l'attesa della prima guerra mondiale ha generato un grande bisogno di composti azotati. Haber ha aperto la strada alla produzione di ammoniaca dall'azoto nell'aria. Se l'ammoniaca viene posta in un contenitore chiuso, si decompone secondo la seguente equazione chimica sbilanciata: NH3(g) → N2(g) + H2(g). Le variazioni delle concentrazioni nel tempo sono illustrate nella figura seguente:

Dall'analisi della figura sopra, possiamo affermare che le curve A, B e C rappresentano la variazione temporale delle concentrazioni dei seguenti componenti di reazione, rispettivamente:
a) H2, no2 e NH3
b) NH3, H2 e no2
c) NH3, no2 e H2
d) No2, H2 e NH3
e) H2, NH3 e no2
Risposta corretta: d) N2, H2 e NH3.
1° passo: bilanciare l'equazione chimica.
2 NH3(g) → N2(g) + 3 H2(g)
Con la reazione bilanciata, ci siamo resi conto che occorrono 2 moli di ammoniaca per decomporsi in azoto e idrogeno. Inoltre, la quantità di idrogeno prodotta nella reazione è tre volte maggiore di quella dell'ammoniaca.
2° passo: interpretare i dati del grafico.
Se l'ammoniaca viene decomposta, nel grafico la sua concentrazione è massima e diminuisce, come si vede nella curva C.
I prodotti, man mano che si formano, all'inizio della reazione le concentrazioni sono nulle e aumentano man mano che il reagente diventa un prodotto.
Poiché la quantità di idrogeno prodotta è tre volte maggiore di quella dell'azoto, allora la curva per questo gas è la più grande, come notato in B.
L'altro prodotto che si forma è l'azoto, come si vede nella curva A.
4. (Cesgranrio) Il sistema rappresentato dall'equazione era in equilibrio. Lo stato di equilibrio è stato bruscamente alterato da un'aggiunta di sostanza G. Il sistema reagisce per ripristinare l'equilibrio. Quale dei seguenti grafici rappresenta meglio i cambiamenti avvenuti durante il processo descritto?
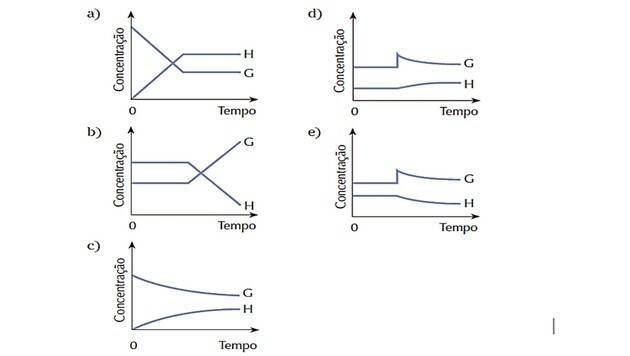
Risposta corretta: d).

Poiché il sistema era in equilibrio all'inizio, le quantità di sostanze G e H sono rimaste costanti.
Il disturbo si è verificato all'aumentare della concentrazione di G e il sistema ha reagito trasformandolo reagente in più prodotto H, spostando l'equilibrio a destra, cioè favorendo la reazione diretto.
Osserviamo che la curva del reagente G diminuisce man mano che viene consumata e la curva del prodotto H aumenta man mano che si forma.
Quando si stabilisce un nuovo equilibrio, le quantità tornano a essere costanti.
Costante di equilibrio: relazione tra concentrazione e pressione
5. (UFRN) Sapendo che KP = Kç (RT)n, possiamo dire che KP = Kç, per:
acciaio2(g) + H2(g) CO(g) + H2oh(g)
b) H2(g) + ½ il2(g) H2oh(1)
c) No2(g) + 3 H2(g) 2 NH3(g)
d) NO(g) + ½ O2(g) NO2(g)
e) 4 FeS(S) + 72(g) 2 Fe2oh3(i) + 4 SO2(g)
Risposta corretta: a) CO2(g) + H2(g) CO(g) + H2oh(g)
a KP essere uguale a Kç la variazione del numero di moli deve essere uguale a zero, in quanto qualsiasi numero elevato a zero risulta in 1:
KP = Kç (RT)0
KP = Kç x 1
KP = Kç
La variazione del numero di moli è calcolata da:
∆n = Numero di moli di prodotti - Numero di moli di reagenti
A questo calcolo partecipano solo i coefficienti delle sostanze allo stato gassoso.
Applicando a ciascuna equazione alternativa, abbiamo:
| acciaio2(g) + H2(g) CO(g) + H2oh(g) | ∆n = [(1+1) - (1+1)] = 2 - 2 = 0 |
| b) H2(g) + ½ il2(g) H2oh(1) | ∆n = [0 - (1+1/2)] = 0 - 3/2 = - 3/2 |
| c) No2(g) + 3 H2(g) 2 NH3(g) | ∆n = [2 - (1+3)] = 2 - 4 = - 2 |
| d) NO(g) + ½ il2(g) NO2(g) | ∆n = [1 - (1+1/2)] = 1 - 3/2 = - 1/2 |
| e) 4 FeS(S) + 72(g) 2 Fe2oh3(i) + 4 SO2(g) | ∆n = [(0+4) - (0+7)] = 4 - 7 = - 3 |
Con questi risultati, possiamo osservare che l'alternativa il cui valore corrisponde al risultato richiesto è quella nella prima equazione.
6. (adattato per UEL) Per la reazione rappresentata da le costanti di equilibrio Kç e KP sono espressi dalle equazioni: (Dato: p = pressione parziale)
Alternativa corretta:
La costante di equilibrio è calcolata da:
I composti solidi, a causa delle loro concentrazioni costanti, non partecipano al calcolo di Kç, quindi, la costante di equilibrio per l'equazione data è:
Per la costante di equilibrio, in termini di pressione, solo i gas partecipano al calcolo, quindi:
Calcolo della costante di equilibrio
7. (Enem/2015) Diversi acidi sono utilizzati nelle industrie che smaltiscono i loro effluenti in corpi idrici, come fiumi e laghi, che possono influenzare l'equilibrio ambientale. Per neutralizzare l'acidità si può aggiungere all'effluente sale di carbonato di calcio, in quantità adeguate, in quanto produce bicarbonato, che neutralizza l'acqua. Le equazioni coinvolte nel processo sono presentate:
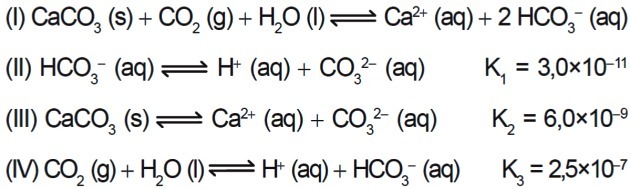
In base ai valori delle costanti di equilibrio delle reazioni II, III e IV a 25°C, qual è il valore numerico della costante di equilibrio della reazione I?
a) 4,5 x 10-26
b) 5,0 x 10-5
c) 0,8 x 10-9
d) 0,2 x 105
e) 2,2 x 1026
Risposta corretta: b) 5,0 x 10-5
1° passo: utilizzare la legge di Hess per apportare le modifiche necessarie.
Data un'equazione chimica:
La costante è calcolata da:
Ma se invertiamo l'equazione, otteniamo come risultato:
E la costante diventa l'inversa:
Per arrivare all'equazione 1, data nella domanda, dobbiamo invertire l'equazione II, come nell'esempio precedente.
2° passo: manipolare le equazioni II, III e IV per arrivare al risultato dell'equazione I.
3° passo: calcolare la costante di equilibrio dell'equazione I.
Calcolo di Kio si ottiene moltiplicando i valori costanti.
Poiché nel calcolo abbiamo uguali potenze delle basi, ripetiamo la base e aggiungiamo gli esponenti.
Poiché ora abbiamo una divisione con uguali potenze delle basi, ripetiamo la base e sottraiamo gli esponenti.
8. (UnB) Il pentacloruro di fosforo è un reagente molto importante nella chimica organica. Si prepara in fase gassosa attraverso la reazione:
Una bottiglia da 3,00 L contiene all'equilibrio, a 200 °C: 0,120 mol PCl5(g), 0,600 moli di PCl3(g) e 0,0120 moli di CL2(g). Qual è il valore della costante di equilibrio a questa temperatura?
Risposta corretta: 50 (mol/L)-1
1° passo: Assemblare l'espressione della costante di equilibrio per la reazione.
2° passo: calcolare le concentrazioni in mol/L di ciascun componente all'equilibrio.
Formula di concentrazione molare:
| PCl3 | Cl2 | PCl5 |
3° passaggio: sostituire le concentrazioni nell'espressione costante e calcolare il valore di Kç.
Applicazioni per l'equilibrio di equilibrio
9. (Enem/2016) Dopo la loro completa usura, i pneumatici possono essere bruciati per generare energia. Tra i gas generati nella combustione completa della gomma vulcanizzata, alcuni sono inquinanti e causano piogge acide. Per evitare che fuoriescano nell'atmosfera, questi gas possono essere fatti gorgogliare in una soluzione acquosa contenente una sostanza adatta. Considerare le informazioni sulla sostanza elencate nella tabella.
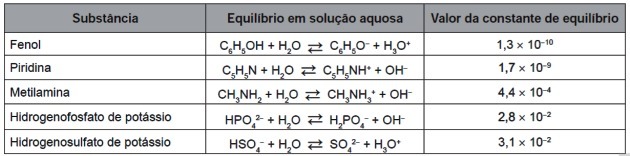
Tra le sostanze elencate in tabella, quella in grado di rimuovere nel modo più efficiente i gas inquinanti è (a)
a) Fenolo.
b) Piridina.
c) Metilamina.
d) Potassio idrogenofosfato.
e) Potassio idrogeno solforato.
Risposta corretta: d) Idrogenofosfato di potassio.
il CO2, ossidi di zolfo (SO2 e così3) e ossidi di azoto (NO e NO2) sono i principali gas inquinanti.
Quando reagiscono con l'acqua presente nell'atmosfera, c'è un formazione di acido che provocano un aumento dell'acidità della pioggia, motivo per cui si chiama pioggia acida.
Le costanti di equilibrio riportate in tabella sono calcolate dal rapporto tra le concentrazioni dei prodotti e dei reagenti come segue:
Si noti che la costante di equilibrio è proporzionale alla concentrazione dei prodotti: maggiore è la quantità di prodotti, maggiore è il valore di Kç.
Nota il primo e l'ultimo valore composto nella tabella per Kç:
| piridina | ||
| Potassio idrogeno solforato |
Confrontando i due numeri, vediamo che minore è la potenza negativa, maggiore è il valore della costante.
Per rimuovere gli inquinanti in modo più efficiente, OH- reagire con gli ioni H+ presente negli acidi attraverso a reazione di neutralizzazione.
Tra le sostanze presentate, quelle che producono gli idrossili necessari per neutralizzare i composti acidi sono: piridina, metilammina e potassio idrogeno fosfato.
Per scoprire quale composto è il più efficiente, osserviamo le costanti di equilibrio: maggiore è il valore della costante, maggiore è la concentrazione di OH-.
Pertanto, la soluzione acquosa contenente una sostanza adatta a questo scopo è l'idrogeno fosfato di potassio, poiché è più basico e neutralizza gli acidi in modo più efficiente.
Per saperne di più, leggi questi testi.:
- equilibrio ionico
- Reazione di neutralizzazione
10. (Enem/2009) I saponi sono sali di acidi carbossilici a catena lunga utilizzati per facilitare, durante i processi di lavaggio, la rimozione di sostanze a bassa solubilità in acqua, ad es. oli e grassi. La figura seguente rappresenta la struttura di una molecola di sapone.
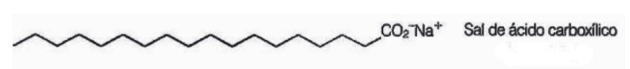
In soluzione, gli anioni del sapone possono idrolizzare l'acqua e formare così il corrispondente acido carbossilico. Ad esempio, per lo stearato di sodio, si stabilisce il seguente equilibrio:
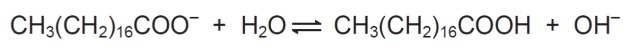
Poiché l'acido carbossilico formato è poco solubile in acqua e meno efficace nella rimozione dei grassi, il pH del mezzo deve essere controllato in modo tale da evitare che l'equilibrio soprastante si sposti verso destra.
Sulla base delle informazioni nel testo, è corretto concludere che i saponi funzionano in un modo:
a) Più efficiente a pH basico.
b) Più efficiente a pH acido.
c) Più efficiente a pH neutro.
d) Efficiente su qualsiasi intervallo di pH.
e) Più efficiente a pH acido o neutro.
Risposta: a) Più efficiente a pH basico.
Nel bilancio mostrato, vediamo che lo stearato di sodio quando reagisce con l'acqua forma un acido carbossilico e un idrossile.
Lo scopo del controllo del pH non è quello di consentire la formazione di acido carbossilico, e questo viene fatto spostando l'equilibrio modificando la concentrazione di OH-.
più OH- in soluzione si ha un disturbo lato prodotti e il sistema chimico reagisce consumando la sostanza la cui concentrazione è aumentata, in questo caso l'ossidrile.
Di conseguenza, ci sarà la trasformazione dei prodotti in reagenti.
Pertanto, i saponi funzionano in modo più efficiente a pH basico poiché l'idrossile in eccesso sposta l'equilibrio a sinistra.
Se il pH fosse acido, ci sarebbe una maggiore concentrazione di H+ che influenzerebbe l'equilibrio consumando OH- e l'equilibrio agirebbe producendo più idrossile, spostando l'equilibrio a sinistra e producendo più acido carbossilico, che non è di interesse nel processo presentato.
Spostamento dell'equilibrio chimico
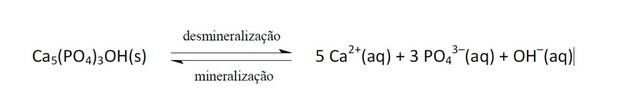
11. (Enem/2011) Le bevande analcoliche sono diventate sempre più l'obiettivo delle politiche di salute pubblica. I prodotti a base di colla contengono acido fosforico, una sostanza dannosa per la fissazione del calcio, il minerale che è il componente principale della matrice dei denti. La carie è un processo dinamico di squilibrio nel processo di demineralizzazione dentale, perdita di minerali dovuta all'acidità. È noto che il componente principale dello smalto dei denti è un sale chiamato idrossiapatite. La soda, per la presenza di saccarosio, abbassa il pH del biofilm (placca batterica), provocando la demineralizzazione dello smalto dentale. I meccanismi di difesa salivare impiegano dai 20 ai 30 minuti per normalizzare il livello di pH, rimineralizzando il dente. La seguente equazione chimica rappresenta questo processo:
 GROISMAN, S. L'impatto della soda sui denti viene valutato senza toglierlo dalla dieta. Disponibile in: http://www.isaude.net. Consultato il: 1 maggio 2010 (adattato).
GROISMAN, S. L'impatto della soda sui denti viene valutato senza toglierlo dalla dieta. Disponibile in: http://www.isaude.net. Consultato il: 1 maggio 2010 (adattato).
Considerando che una persona consuma quotidianamente bevande analcoliche, può verificarsi un processo di demineralizzazione dentale, dovuto all'aumentata concentrazione di
a) OH–, che reagisce con gli ioni Ca2+, spostando l'equilibrio a destra.
b) H+, che reagisce con gli ossidrili OH–, spostando l'equilibrio a destra.
c) OH–, che reagisce con gli ioni Ca2+, spostando l'equilibrio a sinistra.
d) H+, che reagisce con gli ossidrili OH–, spostando l'equilibrio a sinistra.
e) Ca2+, che reagisce con gli ossidrili OH–, spostando l'equilibrio a sinistra.
Risposta corretta: b) H+, che reagisce con gli ossidrili OH–, spostando l'equilibrio a destra.
Quando il pH diminuisce è perché è aumentata l'acidità, cioè la concentrazione di ioni H+, come dice la dichiarazione, c'è la presenza di acido fosforico.
Questi ioni reagiscono con OH- provocando il consumo di questa sostanza e, di conseguenza, spostando l'equilibrio verso destra, poiché il sistema agisce producendo più di questi ioni rimossi.
Lo spostamento dell'equilibrio tra reagenti e prodotti si è verificato a causa della diminuzione della concentrazione di OH-.
Se gli ioni Ca2+ e oh- se la concentrazione fosse aumentata, sposterebbe l'equilibrio a sinistra, in quanto il sistema reagirebbe consumandole e formando altra idrossiapatite.
La modifica del precedente bilanciamento, relativo alla perdita di refrigerante nelle condizioni descritte, comporta:
a) rilascio di CO2 per l'ambiente.
b) Aumentare la temperatura del contenitore.
c) Elevazione della pressione interna del contenitore.
d) Elevazione della concentrazione di CO2 nel liquido.
e) Formazione di una quantità significativa di H2O.
Risposta corretta: a) Rilascio di CO2 per l'ambiente.
All'interno della bottiglia, l'anidride carbonica è stata disciolta nel liquido a causa dell'alta pressione.
Quando si apre la bottiglia, la pressione all'interno del contenitore (che era maggiore) eguaglia la pressione nell'ambiente e, con essa, si ha una fuoriuscita di anidride carbonica.
Lo spostamento di equilibrio tra reagenti e prodotti si è verificato a causa della diminuzione della pressione: quando la pressione diminuisce, l'equilibrio si sposta al volume più grande (numero di moli).
La reazione si è spostata a sinistra e la CO2 che era disciolto nel liquido è stato rilasciato, fuoriuscendo quando la bottiglia è stata aperta.

