Secondo il modello degli orbitali creato da Linus Pauling nel 1960, il legame covalente che forma il molecole avviene per fusione o compenetrazione di orbitali incompleti degli elementi coinvolti nella Collegamento. Pertanto, si conclude che se l'elemento ha un orbitale incompleto (con un solo elettrone), può solo creare un legame covalente. Se ha due orbitali incompleti, può fare un massimo di due connessioni e così via.
Tuttavia, guarda gli orbitali atomici dell'elemento atomo di carbonio, che ha il numero atomico pari a 6 (Z = 6):
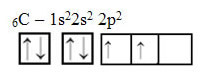
Nota che ha due orbitali incompleti, quindi dovrebbe eseguire solo due associazioni al massimo. Tuttavia, non è quello che gli succede. Come molti sanno, il carbonio forma quattro legami (è tetravalente), quindi questo modello di orbitali non spiega il caso del carbonio.
Per porre fine a questa impasse, è stata creata una nuova teoria che ha spiegato meglio questo problema: il Teoria dell'ibridazione.

Ciò significa che l'ibridazione è un "mix" di orbitali puri.
Per il carbonio esistono tre tipi di ibridazione, che sono: sp3, sp2 e sp.
Per capire come avviene l'ibridazione, diamo un'occhiata al primo tipo di ibridazione del carbonio, il tipo sp.3:
Questo tipo di ibridazione avviene nella molecola di metano (CH4). Nota che ci sono quattro legami covalenti identici tra il carbonio, che è l'elemento centrale, e quattro idrogeni. Quindi, guarda qual è l'orbitale dell'idrogeno incompleto:
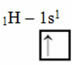
Poiché ogni idrogeno ha un orbitale di tipo s incompleto, è necessario ricevere un altro elettrone, cioè ognuno forma un solo legame covalente con il carbonio. Ecco perché il carbonio deve avere quattro orbitali incompleti. Come avviene? Attraverso l'ibridazione.
Quando un elettrone dell'orbitale 2s assorbe energia, passa nell'orbitale 2p vuoto. Quindi, diciamo che questo salto dell'elettrone dal sottolivello 2s al sottolivello 2p è una "promozione" dell'elettrone. In questo modo, il carbonio rimane nel suo stato eccitato o attivato, con quattro orbitali ibridati disponibili per svolgere i legami covalenti:
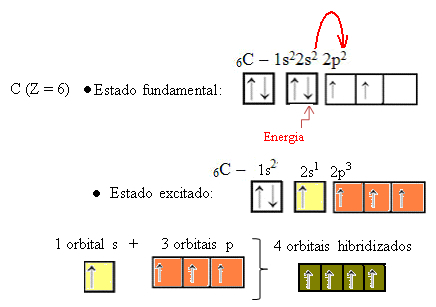
Si noti che gli orbitali ibridi formati sono equivalenti tra loro, ma diversi dagli orbitali puri originali.
In questo modo, il legame tra l'orbitale s di ciascuno dei quattro atomi di idrogeno avviene con questi quattro orbitali di carbonio ibridati:
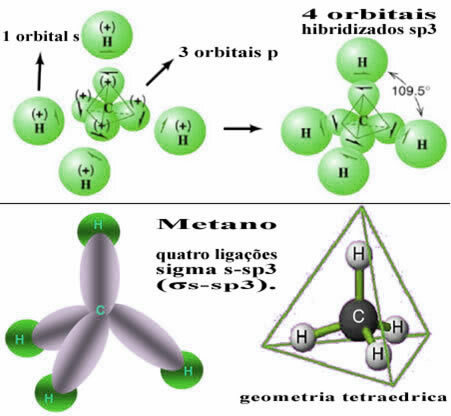
Come visto sopra, la molecola di metano ha una struttura tetraedrica regolare, con le quattro nuvole di elettroni in ogni vertice e angoli adiacenti di 109°28'. Poiché il legame è stato creato tra un orbitale s di ciascun idrogeno e un orbitale sp ibridato3 per ogni chiamata, quindi abbiamo che sono quattro collegamenti sigma s-sp3 (σs-sp3).
di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm

