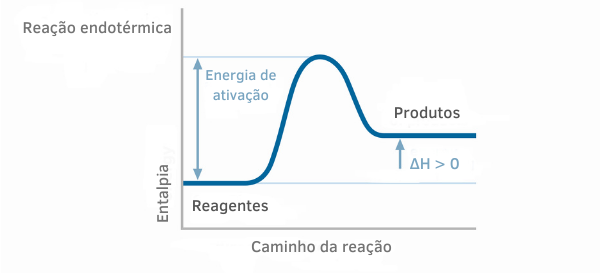
Il calore latente, detto anche calore di trasformazione, è una grandezza fisica che designa la quantità di calore ricevuta o ceduta da un corpo al variare del suo stato fisico.
È importante evidenziare che in questa trasformazione la temperatura rimane la stessa, cioè non considera questa variazione.
Ad esempio, possiamo pensare a un cubetto di ghiaccio che si sta sciogliendo. Quando inizia a cambiare il suo stato fisico (da solido a liquido), la temperatura dell'acqua rimane la stessa in entrambi gli stati.
Formula
Per calcolare il calore latente si usa la formula:
Q = m. l
Dove,
Q: quantità di calore (calce o J)
m: massa (g o kg)
l: calore latente (cal/g o J/Kg)
Nel Sistema Internazionale (SI), il calore latente è espresso in J/Kg (Joule per chilogrammo). Ma può anche essere misurato in cal/g (calorie per grammo).
Nota che il calore latente può avere valori negativi o positivi. Quindi, se la sostanza cede calore, il suo valore sarà negativo (processo esotermico). Ciò si verifica nel solidificazione e liquefazione.
Se invece riceve calore, il valore sarà positivo (processo endotermico). Ciò si verifica nel Fusione e via vaporizzazione.
Leggi di più: Reazioni endotermiche ed esotermiche.
Calore latente di vaporizzazione
Nel calore latente avviene il cambiamento di stato fisico. Cioè, la sostanza può cambiare da solida a liquida, da liquida a gassosa e viceversa.
Quando il cambiamento è da fase liquida in fase gassosa il calore latente è detto calore di vaporizzazione (Lv).

Grafico della variazione della temperatura dell'acqua e dei cambiamenti dello stato fisico
Il calore latente di vaporizzazione dell'acqua è di 540 cal/g. Cioè, sono necessarie 540 cal per far evaporare 1 g di acqua a 100 °C.
In questo caso, la quantità di calore necessaria (Q) è proporzionale alla massa della sostanza (m):
Q = Liv. m
Dove,
Lv: costante
Leggi anche: Stati fisici dell'acqua e Punto di fusione e punto di ebollizione.
Calore specifico
oh calore specifico è la quantità di calore necessaria per aumentare la temperatura di 1°C di 1 g dell'elemento. Ogni elemento ha un calore specifico.
Si calcola con la formula:
c = Q/m. Δθ o c = C/m
Dove,
ç: calore specifico (cal/g°C o J/Kg. K)
Q: quantità di calore (calce o J)
m: massa (g o kg)
Δθ: variazione di temperatura (°C o K)
Ç: capacità termica (cal/°C o J/K)
Nota: A differenza del calore latente, il calore specifico considera la variazione di temperatura (temperatura finale meno temperatura iniziale) che si verifica nel corpo.
Calore sensibile
Oltre al calore specifico, il calore sensibile provoca anche variazioni di temperatura. È una quantità diversa dal calore latente, in quanto modifica la temperatura e non il cambiamento di stato.
Un esempio è quando riscaldiamo una barra di metallo. Il risultato sarà osservato dall'aumento della temperatura del materiale, tuttavia, il suo stato solido non cambia.
Per calcolare il calore sensibile si usa la seguente formula:
Q = m. ç. Δθ
Q: quantità di calore sensibile (calce o J)
m: massa corporea (g o kg)
ç: calore specifico della sostanza (cal/g°C o J/Kg°C)
Δθ: variazione di temperatura (°C o K)
Leggi anche:
- Calore e temperatura
- calorimetria
- diffusione del calore
- Capacità termica
Esercizi per l'esame di ammissione con feedback
1. (Unifor-CE) Un cubetto di ghiaccio di massa 100 g, inizialmente alla temperatura di -20 °C, viene riscaldato fino a diventare acqua a 40 °C (dati: calore specifico del ghiaccio 0,50 cal/g °C; calore specifico dell'acqua 1,0 cal/g °C; calore di fusione del ghiaccio 80 cal/g). Le quantità di calore sensibile e calore latente scambiate in questa trasformazione, in calorie, sono state rispettivamente:
a) 8.000 e 5.000
b) 5.000 e 8.000
c) 5.000 e 5.000
d) 4.000 e 8.000
e) 1.000 e 4.000
Alternativa b) 5.000 e 8.000
2. (UNIP-SP) Il calore specifico latente del ghiaccio fondente è 80 cal/g. Per sciogliere una massa di ghiaccio di 80 g, senza variazione di temperatura, la quantità di calore latente necessaria è:
a) 1.0 cal
b) 6,4 cal
c) 1,0 kcal
d) 64 kcal
e) 6.4. 103cal
Alternativa e) 6.4. 103cal
3. (FUVEST) Utilizzare acqua a 80°C e ghiaccio a 0°C. Si desidera ottenere 100 grammi di acqua alla temperatura di 40°C (dopo l'equilibrio), mescolando acqua e ghiaccio in un recipiente isolante con capacità termica trascurabile. È noto che il calore specifico latente del ghiaccio fondente è 80 cal/ge il calore specifico sensibile dell'acqua è 1,0 cal/g°C. La massa di ghiaccio da utilizzare è:
a) 5,0 g
b) 12,5 g
c) 25 g
d) 33 g
e) 50 g
Alternativa c) 25g