oh principio di Le Chatelier ci dice che quando viene causato un disturbo a un sistema in equilibrio, questo si sposterà nella direzione che minimizza le forze create da quel disturbo e ripristina un nuovo equilibrio chimico.
Uno di questi disturbi è il variazione di temperatura. Questa variazione è importante perché, oltre a provocare lo spostamento dell'equilibrio, cambierà anche il valore della costante di equilibrio, Kç.
Per farti capire meglio come ciò accade, diamo un'occhiata a un esempio:
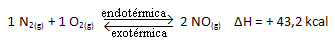
Kç = _[ AL]2___
[N2]. [O2]
La suddetta reazione avviene nella direzione diretta con assorbimento di energia, è endotermica. Il processo inverso, invece, avviene con il rilascio di energia, essendo una reazione esotermica.
Quindi, se aumentiamo la temperatura del sistema, l'equilibrio chimico si sposterà verso la reazione endotermica, che in questa reazione è a destra. In questo modo si assorbe il calore e si ritrova l'equilibrio.
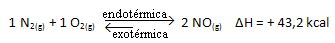
È vero anche il contrario; se abbassiamo la temperatura di questo sistema, la reazione si sposterà nella direzione in cui rilascerà calore, perché l'energia totale della reazione diminuirà. Ciò significa che l'equilibrio si sposterà verso la reazione esotermica, che in questo caso è a sinistra:
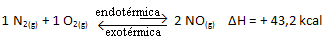
In breve:

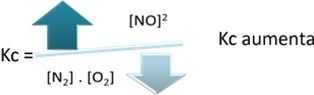
In relazione alla costante di equilibrio (Kç), quando la temperatura aumenta, favorisce la reazione endotermica e più NO more(g) si forma aumentando la sua concentrazione e diminuendo la concentrazione dei reagenti. Nota nella formula seguente che la concentrazione di NO(g) è direttamente proporzionale alla costante Kç, quindi, aumenta anche:
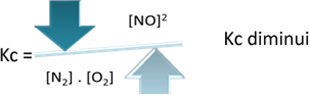
Ma se diminuiamo la temperatura, spostando la reazione verso la reazione esotermica, la concentrazione del prodotto NO diminuirà e le concentrazioni dei reagenti aumenteranno. Poiché le concentrazioni dei reagenti sono inversamente proporzionali alla costante Kc, allora diminuirà:
di Jennifer Fogaça
Laureato in Chimica
Fonte: Scuola Brasile - https://brasilescola.uol.com.br/quimica/variacao-temperatura-deslocamento-equilibrio-quimico.htm
