Gli ossidi acidi sono quegli ossidi che, reagendo con l'acqua, producono un acido come prodotto. Quando reagiscono con una base, i prodotti saranno sale e acqua.
Questi composti hanno solitamente un carattere covalente, cioè sono molecolari, solubili in acqua e formati principalmente da non metalli, che sono elementi ad alta elettronegatività. Quando sono formati da metalli, questi hanno un alto numero di ossidazione (carica elettrica).
Esempi:
CO2, SOLO2, SOLO3, P2oh5, Cl2oh6, AL2, no2oh4, no2oh5, eccetera.
Quello che segue è uno schema generale di reazioni caratteristiche per gli ossidi acidi e un esempio:
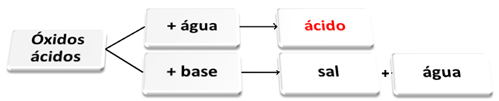
Ossidi acidi che reagiscono con l'acqua e con la base
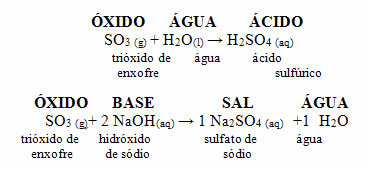
Gli ossidi acidi sono anche chiamati anidridi, perché questa parola viene dal greco anidro, che significa "no acqua", e gli ossidi acidi possono essere considerati un "acido senz'acqua".
Proprietà e applicazioni di alcuni ossidi acidi:
• Anidride carbonica (anidride carbonica) - CO2:
Questo composto viene utilizzato come gas nelle bibite e nelle acque minerali, perché sottoposto ad alta pressione diventa solubile in acqua. Produce in questi prodotti un mezzo acido, in quanto è un ossido acido che reagisce con l'acqua, producendo un acido, secondo la reazione seguente:

Al di sotto dei 78 °C, è allo stato solido ed è noto come ghiaccio secco, da cui prende il nome perché il suo aspetto ricorda il ghiaccio. comune, ma non fonde, passando allo stato liquido a temperatura ambiente, ma passa allo stato di vapore, cioè sublima. Pertanto, questa funzione viene utilizzata come risorsa scenica in concerti, film, teatri, feste, ecc.

L'anidride carbonica è un ossido acido
Si trova anche nell'atmosfera a causa della respirazione umana, della combustione di combustibili fossili (carbone, prodotti petroliferi, alcol, ecc.) e degli incendi boschivi. Quindi, è uno dei responsabili delle piogge acide.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
• Ossidi di zolfo - SO2 e così3
Questi ossidi sono presenti anche nell'atmosfera, essendo di origine naturale e artificiale. Il naturale avviene attraverso eruzioni vulcaniche e decomposizione di piante e animali. L'artificiale corrisponde alla maggior quantità di questi ossidi nell'atmosfera, così come sono espulso bruciando combustibili fossili, principalmente gasolio, che contiene zolfo come impurità.
Anidride solforosa (SO2) reagisce con l'ossigeno dell'atmosfera producendo anidride solforosa (SO3). Quando quest'ultimo ossido reagisce con l'acqua piovana, si forma acido solforico, che è molto forte e provoca danni.
• Zolfo da combustione da combustibili: S + O2 → Sistema operativo2
• Trasformazione di SO2 in SO3: SO2 + ½ il2 → Sistema operativo3
Reazioni di SO2 e SO3 con acqua che danno acidi: SO2 + H2O → H2SOLO3
SOLO3 + H2O → H2SOLO4
• Tetrossidi di diazoto (anidride nitrosa-nitrica) - N2oh4
Questo composto ha un punto di ebollizione di 22ºC, è di colore giallo ed è piuttosto volatile. Si forma nell'atmosfera per ossidazione dell'azoto e può essere in forma liquida, sotto forma di dimero di biossido di azoto o di ossido nitrico (NO2). Al di sopra di tale temperatura assume la forma di NO2:
no2oh4 NO2
È un gas estremamente tossico e la sua inalazione è fatale. Viene anche utilizzato nella composizione dei combustibili per missili.
di Jennifer Fogaça
Laureato in Chimica



