La struttura proteica si riferisce alla sua conformazione naturale necessaria per svolgere le sue funzioni biologiche.
Le proteine sono macromolecole formate dall'unione di amminoacidi.
Gli amminoacidi sono legati tra loro da legami peptidici. Le molecole risultanti dall'unione degli amminoacidi sono chiamate peptidi.
Le proteine hanno quattro livelli strutturali: struttura primaria, secondaria, terziaria e quaternaria.
Struttura primaria delle proteine
La struttura primaria corrisponde a sequenza di amminoacidi lineare uniti da legami peptidici.
In alcune proteine, la sostituzione di un amminoacido con un altro può causare malattie e persino la morte.
Strutture spaziali delle proteine
Le strutture spaziali delle proteine derivano dal ripiegamento e ripiegamento del filamento proteico su se stesso.
Le proprietà funzionali delle proteine dipendono dalla loro struttura spaziale.
Struttura Secondaria
La struttura secondaria corrisponde al primo livello di avvolgimento elicoidale.
È caratterizzato da schemi regolari e ripetitivi che si verificano localmente, causati dall'attrazione tra alcuni atomi di amminoacidi vicini.
Le due disposizioni locali più comuni che corrispondono alla struttura secondaria sono alfa-elica e beta-foglia o beta-plissettate.
- conformazione ad alfa elica: caratterizzato da una disposizione tridimensionale in cui la catena polipeptidica assume conformazione elicoidale attorno ad un asse immaginario.
- conformazione del foglio beta: si verifica quando la catena polipeptidica si estende a zig-zag e può essere affiancata.
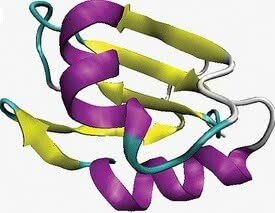
Struttura secondaria. In viola la conformazione ad alfa-elica e in giallo la foglia beta
Struttura terziaria
La struttura terziaria corrisponde al ripiegamento della catena polipeptidica su se stessa.
Nella struttura terziaria, la proteina assume una specifica forma tridimensionale a causa del ripiegamento globale dell'intera catena polipeptidica.
Struttura quaternaria
Mentre molte proteine sono formate da una singola catena polipeptidica. Altri sono costituiti da più di una catena polipeptidica.
La struttura quaternaria corrisponde a due o più catene polipeptidiche, identiche o meno, che si raggruppano e si incastrano per formare la struttura totale della proteina.
Ad esempio, la molecola dell'insulina è costituita da due catene interconnesse. Nel frattempo, l'emoglobina è composta da quattro catene polipeptidiche.
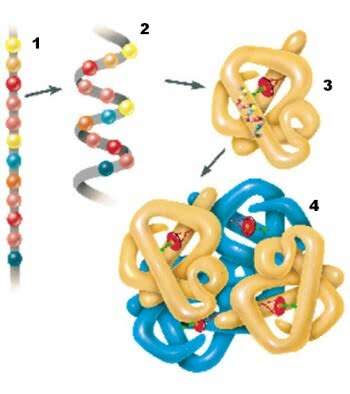
1. struttura primaria; 2. struttura secondaria; 3. struttura terziaria; 4. Struttura quaternaria.
Impara di più riguardo proteine.
Denaturazione delle proteine
Per svolgere le loro funzioni biologiche, le proteine devono presentare la loro conformazione naturale.
Calore, acidità, concentrazione di sale, tra le altre condizioni ambientali, possono alterare la struttura spaziale delle proteine. Di conseguenza, le loro catene polipeptidiche si srotolano e perdono la loro conformazione naturale.
Quando ciò accade, lo chiamiamo denaturazione delle proteine.
Il risultato della denaturazione è la perdita della funzione biologica caratteristica di quella proteina.
Tuttavia, la sequenza degli amminoacidi non viene alterata. La denaturazione corrisponde solo alla perdita di conformazione spaziale delle proteine.
Per saperne di più, leggi anche su peptidi e legami peptidici.


