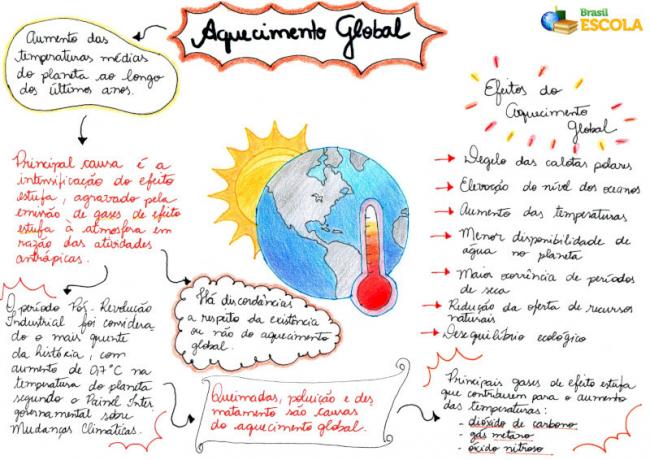
I cloruri sono quei composti ionici che contengono l'anione Cℓ-1.
Il cloro è della famiglia 17 o 7A, il suo numero atomico è 17 e ha 7 elettroni nel guscio di valenza (il guscio elettronico più esterno dell'atomo). Secondo regola dell'ottetto, per essere stabile, ha bisogno di avere 8 elettroni in quest'ultimo guscio e quindi ha bisogno di ricevere un elettrone in più. Quando ciò accade, cioè quando riceve un elettrone, in generale, da un legame ionico con un metallo, si forma la â.cloruro di ioni (Cℓ-1), il metallo che ha ceduto l'elettrone diventa un catione e la sostanza formata è ionica.
I cloruri sono sali derivati dalla reazione di una base con acido cloridrico (HCℓ(Qui)). La base fornisce il catione e l'acido cloridrico fornisce lo ione cloruro:
Base generica + acido cloridrico → Cloruro + Acqua
ÇOH+HCℓ → ÇCℓ + H2oh
I cloruri sono tutti classificati come sali inorganici, perché in un mezzo acquoso rilasciano un catione diverso da H+ e rilasciare l'anione cloruro, non l'idrossile (OH-).
La nomenclatura dei cloruri segue sempre questa regola: Cloruro +de + (nome dell'elemento legato al cloro). A le tue formule sono formate scambiando le cariche ioniche per gli indici (numero che si trova in basso a destra del simbolo dell'elemento, che indica il numero di atomi di quell'elemento che sono presenti a formare legami).

Se l'indice è "1", non è necessario scriverlo nella formula, come mostrato di seguito:
A+1 Cℓ-1 → A1Cℓ1 → ACℓ: cloruro di sodio;
K+1 Cℓ-1 → KCℓ: cloruro di potassio;
Qui+2 Cℓ-1→CaCℓ2: Cloruro di calcio;
Ba+2 Cℓ-1→BQui2: cloruro di bario;
Aℓ+3 Cℓ-1→ACℓ3: cloruro di alluminio.
Tuttavia, come spiegato nel testo “Sostanze ioniche del gruppo: cloruro, carbonato, nitrato e solfato”, come per tutte le sostanze ioniche, i cloruri non hanno le loro formule unitarie isolate in natura, in quanto i loro ioni si attraggono reciprocamente e formano reticoli cristallini.
L'esempio principale di cloruro che abbiamo nella nostra vita quotidiana è il cloruro di sodio, NaCℓ, il sale da cucina. Vedi il legame ionico che ne risulta nella sua formazione (in cui il sodio dona un elettrone al cloro) e sotto il reticolo cristallino di questo sale:

Nel reticolo cristallino del cloruro di sodio ogni anione Cℓ- è circondato da 6 cationi Na+ e viceversa, quindi il numero di coordinazione di questo reticolo cristallino è 6.
Tutti i cloruri sono solidi in condizioni ambientali e abbastanza solubile in acqua, essendo tra i sali più comuni che si trovano nella nostra vita quotidiana, considerando che molti di loro sono presenti disciolti in acqua minerale, acqua potabile, acqua di rubinetto, fiumi, mari, tra altri. Tra le eccezioni, essendo cloruri insolubili in acqua, vi sono il cloruro d'argento (AgCℓ - mostrato nella figura sottostante), da composti di piombo, rame e mercurio.

Cloruro d'argento insolubile in acqua*
Gli ioni Cℓ-1 dai cloruri che ingeriamo, principalmente nel sale, pesce e carne, sono importanti per alcune funzioni del corpo umano, in quanto sono il principale anione extracellulare, sono presenti nel succo gastrico, regolare i fluidi corporei, come la distribuzione dell'acqua nel corpo, e mantenere la pressione osmotica e la neutralità del plasma elettrico.
La sua carenza può causare ansia, diarrea e problemi circolatori. Il suo eccesso viene escreto attraverso l'urina (in media, ogni persona espelle circa 4 g di cloruro al giorno), il sudore e le feci.
*Credito immagine: Autore: Danny S. / Immagine estratta da: Wikimedia Commons
di Jennifer Fogaça
Laureato in Chimica