Il volume atomico non è il volume che occupa un atomo, ma si riferisce alla volume occupato da una quantità fissa di un dato numero di atomi di un elemento chimico.
Nel testo Elemento chimico, è stato dimostrato che un elemento corrisponde a un insieme di atomi che hanno lo stesso numero atomico, cioè la stessa quantità di protoni nel nucleo. La quantità stabilita per calcolare il volume atomico è il valore di La costante di Avogadro, che è pari a 6,02. 1023 atomi, che corrisponde a 1 mole dell'elemento.
Quindi possiamo dire che il volume atomico è il volume che 1 mole di atomi (o 6,02). 1023 atomi) di un elemento occupa.
Questa quantità può essere calcolata se conosciamo la densità dell'elemento allo stato solido e la massa di 1 mole di atomi di quell'elemento. Si consideri ad esempio che la densità del sodio (Na) è pari a 0,97 g/cm3 e che 6.02. 1023 gli atomi di sodio hanno una massa pari a 23,0 g. Possiamo quindi, dalla formula della densità, arrivare al volume atomico del sodio. Vedi come:
densità = pasta
volume
volume atomico = massa di 6,02. 1023 atomi dell'elemento
densità dell'elemento allo stato solido
Volume atomico di sodio = 23,0 g
0,97 g/cm3
Volume atomico di sodio = 23,71 cm3
Il valore del volume atomico coinvolge non solo la dimensione degli atomi, ma anche la distanza tra loro. Quindi, poiché si tratta anche di spazi vuoti, non possiamo prendere il valore del volume atomico e dividere per il numero di atomi (6.02. 1023) per trovare il volume occupato da ciascun atomo.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
È importante studiare il volume atomico perché è una proprietà periodica, cioè varia in base al numero atomico dell'elemento. Guarda l'immagine qui sotto. Il volume atomico degli elementi cresce dall'alto verso il basso, il che significa che quando analizziamo gli elementi appartenenti alla stessa famiglia della Tavola Periodica, al crescere del numero atomico cresce anche il volume atomico. Questo perché, in questo senso, aumentano i periodi, il che significa che aumentano gli strati elettronici degli atomi e, di conseguenza, aumenta anche il volume da essi occupato. Questo è lo stesso senso di crescita di raggio atomico.
D'altra parte, orizzontalmente, vediamo che il volume atomico aumenta dal centro verso i bordi. Quando partiamo da sinistra e andiamo a destra al centro della tavola periodica, il volume atomico diminuisce perché il periodo è lo stesso, cioè gli elementi della stessa linea hanno la stessa quantità di strati elettronici, ma il numero atomico sarà crescente. Ciò significa che la quantità di elettroni aumenta in questa direzione, il che si traduce in una maggiore forza di attrazione degli elettroni al nucleo dell'atomo, diminuendo il suo raggio atomico e, di conseguenza, il volume atomico. Ma dal centro a destra, questo non continua ad accadere, perché, nel caso di elementi situati in questa regione, soprattutto nel caso dei non metalli, la distanza tra i loro atomi è relativamente grande, il che influisce sul volume atomico, aumentandolo.
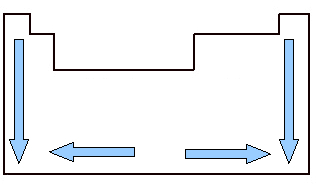
Variazione del volume atomico nella tavola periodica tra famiglie e periodi
di Jennifer Fogaça
Laureato in Chimica