L'analisi delle proprietà fisiche e chimiche dei composti che realizzano legami covalenti (condividendo gli elettroni) ci mostra che ci sono grandi differenze tra questi materiali. Ma prima di esaminare queste caratteristiche in sé, vediamo qual è la differenza tra sostanze molecolari e covalenti.
A sostanze molecolari sono quelli che si formano quando gli atomi si legano tramite legami covalenti, dando origine a molecole di un determinato numero.
Tuttavia, il legame covalente può anche dare origine a composti in una struttura a rete con un numero di atomi molto grande e indeterminato, che sono macromolecole. Tali sostanze sono chiamate composti covalenti o solidi della rete covalente. Alcuni esempi di questi composti sono: diamante (C), grafite (C), biossido di silicio (SiO2) e carburo di silicio (SiC).
Vediamo ora le sue principali proprietà:
- Stato fisico a temperatura ambiente: In condizioni ambientali si trovano composti molecolari e covalenti nei tre stati fisici (solidi, liquidi e gas).
Esempi:
oh Solido: zucchero (saccarosio), silice (sabbia), diamante, grafite;
oh Liquido: acqua, acetone, etanolo;
oh Gassoso: Solfuro di idrogeno, gas di cloro, gas di bromo, gas di idrogeno.

- Punto di fusione e di ebollizione: In generale, i punti di fusione e di ebollizione di queste sostanze sono più piccoli di quelli delle sostanze ioniche.
Le sostanze covalenti hanno temperature di ebollizione più alte di quelle molecolari, sempre superiori a 1000°C. Questo perché poiché le loro molecole sono più strettamente unite, formando reticoli cristallini, è necessario fornire più energia per farle cambiare stato.
Due fattori interferiscono con i punti di ebollizione e fusione dei composti covalenti e molecolari: a massa molare e il forza intermolecolare.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Maggiore è la massa molare, maggiore è l'inerzia della molecola e, di conseguenza, maggiore è il punto di ebollizione e di fusione. Se le masse molari sono approssimate, osserviamo le forze intermolecolari. La forza intermolecolare più intensa è quella del legame idrogeno, che porta a un punto di ebollizione e di fusione più elevato. L'intermedio è il dipolo permanente e il più debole, che porta ad un punto di ebollizione e di fusione più basso, è il dipolo indotto.
- Corrente elettrica: Nella loro forma pura, sia i liquidi che i solidi non conducono corrente elettrica.
Un'eccezione è la grafite, che conduce corrente elettrica in forma solida, perché i suoi elettroni a doppio legame risuonano e quindi hanno una certa mobilità.
- Solubilità: I polari si dissolvono in polari e i non polari si dissolvono in non polari.
- Tenacia: La resistenza delle sostanze covalenti agli urti o agli shock meccanici è bassa. In genere sono solidi fragili, come si vede nel caso del vetro, che è formato da silicati di sodio e calcio.

- Tenacità: In generale, hanno un'elevata durezza. Ad eccezione della grafite, perché i suoi atomi di carbonio sono legati ad altri tre atomi di carbonio, formando placche esagonali con una certa mobilità, rendendola morbida. Per questo motivo viene persino utilizzato come lubrificante.
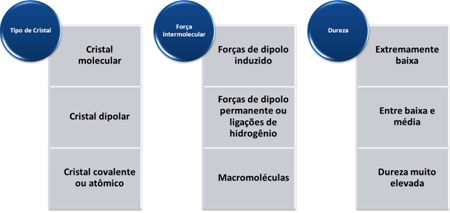
La durezza di queste sostanze varia a seconda del tipo di cristallo, come mostrato nella tabella sottostante:
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Proprietà dei composti covalenti e molecolari"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/propriedades-dos-compostos-covalentes-moleculares.htm. Consultato il 28 giugno 2021.
Composti ionici, principali caratteristiche dei composti ionici, legame tra ioni, trasferimento definitivo di elettroni, forze di attrazione elettrostatica tra ioni, ioni negativi e positivi, anioni, cationi, legame ionico, struttura molecolare lui