Il testo Titolazione ha mostrato come viene eseguita questa tecnica di analisi volumetrica, il cui obiettivo principale è identificare la concentrazione di una soluzione attraverso la sua reazione con un'altra soluzione di concentrazione nota.
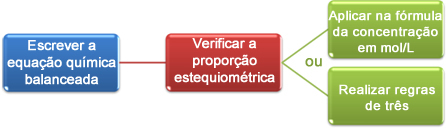
Ora vedremo come utilizzare i dati ottenuti nella titolazione per arrivare alla concentrazione desiderata, che può essere un acido o una base in soluzione. Per farlo, ci sono fondamentalmente tre passaggi:
Vediamo un esempio:
Diciamo che un chimico aveva una soluzione di acido acetico (aceto (CH3COOH(Qui))) e volevo scoprire la sua concentrazione in mol/L. Quindi, ha messo 20,0 ml di aceto (titolato) in una beuta di Erlenmeyer e ha aggiunto l'indicatore di fenolftaleina. Quindi ha riempito una buretta da 100 ml con idrossido di sodio (NaOH) di concentrazione nota (titolante) pari a 1,0 mol/L. Infine, il chimico ha eseguito la titolazione e ha notato che il cambiamento di colore (punto di svolta - quando ha interrotto la titolazione) si è verificato quando sono stati consumati 24 mL di NaOH.

Sulla base di questo esperimento, ha ottenuto i seguenti dati:
MCH3COOH= ?
VCH3COOH = 20 mL = 0,02 L
MNaOH = 24 mL = 0,024 L
VNaOH = 1,0 mol/L
Dove M = concentrazione in mol/L e V = volume in L.
Per conoscere la concentrazione dell'acido acetico dobbiamo prima saper scrivere l'equazione chimica che rappresenta la reazione di neutralizzazione opportunamente bilanciata avvenuta. In questo caso la reazione è la seguente:
1 CH3COOH(Qui) + 1 NaOH(Qui) → 1 NaC2H3oh2(ac) + 1 ora2oh(ℓ)
Questa parte è importante per vedere il rapporto stechiometrico al quale reagiscono i reagenti. Si noti che il rapporto è 1:1, cioè per ogni mole di acido acetico è necessaria 1 mole di idrossido di sodio.
Ora possiamo procedere con i calcoli in due modi:
(1°) Attraverso la formula: M1. V1 = M2. V2
Poiché il rapporto stechiometrico è 1:1, dobbiamo: noCH3COOH = nNaOH .
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Essere M = n/V → n = M V. Arriviamo così alla lista di cui sopra, che può, in questo caso, essere scritta così: MCH3COOH. CH3COOH = MNaOH. VNaOH
Quindi, basta sostituire i valori di questa formula:
MCH3COOH. V CH3COOH = MNaOH. VNaOH
MCH3COOH. 0,02 L = 1,0 mol/L. 0,024 litri
MCH3COOH = 0,024 moli
0,02 litri
MCH3COOH = 1,2 mol/L
Pertanto, la concentrazione iniziale della soluzione di acido acetico, il nostro titolo, era 1,2 mol/l.
Nota importante: Se il rapporto stechiometrico non fosse 1:1, sarebbe sufficiente moltiplicare la concentrazione in mol/L (M) delle sostanze per i rispettivi coefficienti. Ad esempio, se il rapporto fosse 1: 2, avremmo il seguente:
M1. V1 = 2. M2. V2
Ma ecco un altro modo per eseguire questi calcoli:
(2°) Attraverso le regole del tre:
1 CH3COOH(Qui) + 1 NaOH(Qui) → 1 CH3COONa(Qui) + 1 ora2oh(ℓ)
1 mol 1 mol 1 mol 1 mol
1. 60 g 1. 40 gr1. 82 g 1. 18 g
Queste masse sono le masse molecolari calcolate per ciascuna sostanza.
* Sapendo che il volume esaurito della soluzione NaOH 1.0 mol/L(Qui) era 24 mL, possiamo prima scoprire la quantità di materia (mol) di NaOH che ha reagito:
1 mole di NaOH → 1,0 L
1 mole di NaOH 1000 ml
x 24 ml
x = 0,024 moli di NaOH
* Poiché il rapporto è 1:1, la quantità di materia (mol) di acido acetico dovrebbe essere la stessa di NaOH: 0,024 mol.
Osservazione: Se il rapporto stechiometrico fosse diverso, lo terremmo in considerazione in questa parte. Ad esempio, se fosse 1:3 e la quantità di materia di una specie chimica reattiva fosse pari a 0,024 moli, quella dell'altra sostanza sarebbe tripla: 0,072.
* Adesso calcoliamo:
20 ml di aceto 0,024 moli di acido acetico
1000 ml di aceto e
y = 1.2 moli
Cioè, c'è 1.2 mol/L, che è lo stesso valore che abbiamo ottenuto nel metodo precedente.
di Jennifer Fogaça
Laureato in Chimica