Ogni cellula è un dispositivo in cui avviene una reazione spontanea di ossidoriduzione che genera una corrente elettrica, la quale, a sua volta, viene utilizzata per far funzionare alcune apparecchiature.
Questi dispositivi hanno preso il nome perché la prima batteria ad essere creata è stata inventata da Alessandro Nell'anno 1800, era formato da dischi di zinco e rame separati da cotone imbevuto di salamoia. Questo insieme è stato collocato intervallati, uno sopra l'altro, accumulando i dischi e formando una grande colonna. Com'è stato batteria di dischi, cominciò ad essere chiamato con quel nome.

Le batterie sono sempre composte da due elettrodi e un elettrolita. L'elettrodo positivo si chiama a catodo ed è qui che la reazione di riduzione. L'elettrodo negativo è il anodo ed è qui che la reazione di ossidazione. Viene anche chiamato elettrolita ponte di sale ed è la soluzione conduttrice di ioni.
Per farti capire come questo genera corrente elettrica, vedi il caso di una delle prime batterie, la
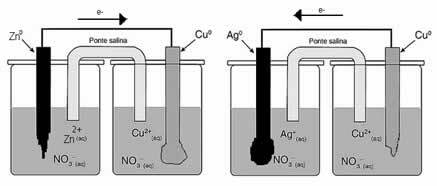
Il mucchio di Daniell, in cui c'era un contenitore con una soluzione di solfato di rame (CuSO4(ac)) e, immersa in tale soluzione, era una lastra di rame. In un altro contenitore separato, c'era una soluzione di solfato di zinco (ZnSO4(ac)) e una lastra di zinco immersa. Le due soluzioni erano collegate da un ponte salino, che era un tubo di vetro con una soluzione di solfato di potassio (K2SOLO4(ac)) con lana di vetro alle estremità. Infine, le due placche erano interconnesse da un circuito esterno, con una lampada, la cui accensione indicherebbe il passaggio di corrente elettrica: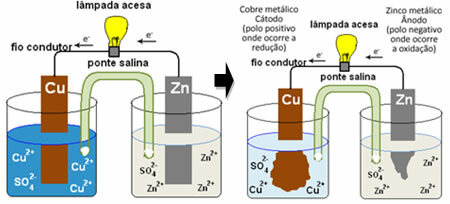
Quello che succede è che lo zinco ha una maggiore tendenza ad ossidarsi, cioè a perdere elettroni, quindi lo zinco metallico della lama funge da elettrodo negativo, l'anodo, dove avviene l'ossidazione: Zn( S) Zn2+(Qui) + 2 e-. Gli elettroni persi dallo zinco vengono trasportati dal circuito esterno al rame, generando la corrente elettrica che accende la lampada. Gli ioni di rame nella soluzione ricevono elettroni (si riducono) e si trasformano in rame metallico che si deposita sulla lamina di rame. Ciò significa che questo è l'elettrodo positivo, catodo, dove avviene la riduzione: Culo2+(Qui) + 2 e- culo( S).
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Le batterie odierne hanno questo stesso principio di funzionamento, in cui un metallo cede elettroni a un altro, attraverso una soluzione conduttiva, e viene prodotta una corrente elettrica. La differenza è che le batterie utilizzate oggi sono a secco, perché non utilizzano una soluzione liquida come elettrolita, come avviene nella batteria di Daniell.
Oggi esiste una vasta gamma di batterie vendute commercialmente. Tra questi i più comuni sono i cellule acide (da Leclanché) e ilbatterie alcaline.
Entrambi hanno lo zinco come elettrodo negativo; come polo positivo, invece, al centro del palo è installata una barra di grafite circondata da biossido di manganese (MnO2), carbone in polvere (C) e una pasta umida. La differenza è che, nella pila acida, viene utilizzato cloruro di ammonio (NH) nella pasta umida.4Cl) e cloruro di zinco (ZnCl2) - sali di carattere acido - oltre all'acqua (H2O). Nella batteria alcalina viene utilizzato idrossido di potassio (KOH), che è una base.

Le batterie Leclanché sono più adatte per apparecchiature che richiedono una scarica leggera e continua, come telecomando, orologio da parete, radio portatile e giocattoli. Le batterie alcaline, d'altra parte, hanno dal 50 al 100% di energia in più rispetto a una batteria comune della stessa dimensione, essendo consigliate per apparecchiature che richiedono download più veloci e intensi come radio, lettori CD/DVD, lettori MP3 portatili, torce elettriche, fotocamere digitali eccetera.

Scopri di più su quali elettroliti ed elettrodi vengono utilizzati anche in questi e altri tipi di batterie. per quanto riguarda i tipi di attrezzatura più consigliati, leggi gli articoli correlati di più sotto.
di Jennifer Fogaça
Laureato in Chimica