Batteria è un sistema in cui l'energia chimica si trasforma spontaneamente in energia elettrica.
Nel 1836 il chimico e meteorologo inglese John Frederic Daniell (1790-1845) costruì una pila diversa da quella allora conosciuta: la pila di Alessandro Volta. In questo mucchio lui interconnessi due elettrodi, che erano sistemi costituiti da un metallo immerso in una soluzione acquosa di un sale formato dai cationi di questo metallo.
Uno degli elettrodi, l'elettrodo di rame, era costituito da una piastra di rame immersa in una soluzione di solfato di rame (CuSO4). L'altro elettrodo era un elettrodo di zinco, costituito da una lastra di zinco immersa in una soluzione di solfato di zinco (ZnSO4).
Questi due elettrodi erano interconnessi da un circuito elettrico che conteneva una lampada, perché se si fosse accesa, indicherebbe l'emergere di una corrente elettrica.
Inoltre, c'era un ponte di sale tra loro. Questo ponte era costituito da un tubo di vetro a forma di U contenente una soluzione acquosa concentrata di un sale altamente solubile, come ad esempio cloruro di potassio (KCl (aq)). Le estremità del tubo sono ricoperte di cotone o agar.
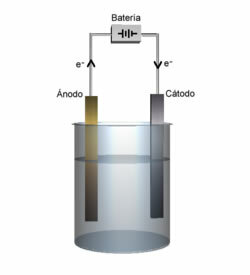
Di seguito abbiamo la struttura di questa cella o cella elettrochimica, che divenne nota come cella di Daniell. Ricordando che ogni elettrodo è chiamato semicella.
A circuito chiuso la lampada si accende e dopo qualche tempo, la lastra di zinco è corrosa e ha la sua massa diminuita, mentre la lastra di rame è l'opposto, la sua massa aumenta (come mostrato nella figura sotto). Si segnala inoltre che c'è un aumento della concentrazione in mol/L degli ioni Zn2+ e una diminuzione degli ioni Cu2+.
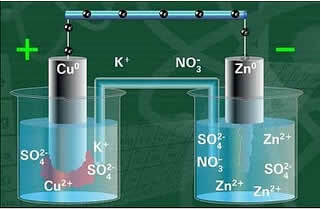
Schema dello stack di Daniell.
Perché sta succedendo?
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Per capire, diamo un'occhiata alle reazioni che avvengono su ciascun elettrodo separatamente.
Nell'elettrodo di Zinco si verifica la seguente reazione di equilibrio:
Zn(s) ↔ Zn2+(Qui) + 2 e-
Ciò significa che lo zinco metallico (dalla lastra) subisce ossidazione, cioè dona due elettroni al catione di zinco (dalla soluzione) e diventa Zn2+. Avviene anche il contrario, il catione zinco presente nella soluzione riceve i due elettroni donati dallo zinco e diventa zinco metallico. Pertanto, vi è un processo ininterrotto di ossidazione e riduzione.
Lo stesso vale per l'elettrodo di rame, che avrà la reazione globale in equilibrio dinamico: Cu(s) ↔ Cu2+(Qui) + 2 e-
Daniell si rese conto che se avesse collegato questi due elettrodi, quello più reattivo avrebbe donato i suoi elettroni al catione meno reattivo invece di farlo con i cationi nella sua stessa soluzione. In questo caso lo zinco è il più reattivo e subisce ossidazione, donando elettroni al rame, da qui la diminuzione della sua massa. L'elettrodo che subisce l'ossidazione è il polo negativo, chiamato anodo. L'elettrodo di rame è quello che subisce la riduzione, il catione rame riceve i due elettroni dallo zinco, e prende il nome di catodo (polo positivo).
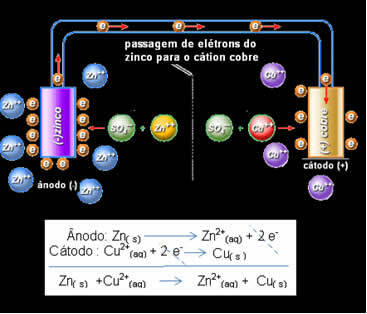
Passaggio di elettroni ed equazione globale dello stack di Daniell.
Sopra abbiamo l'equazione globale per questo stack, che si ottiene sommando le due semireazioni. La sua rappresentazione o notazione chimica è fatta secondo la seguente regola:

Quindi per lo stack di Daniell abbiamo:
Zn / Zn2+// Culo2+ / culo
di Jennifer Fogaça
Laureato in Chimica
Squadra scolastica brasiliana
fisico-chimico - Chimica - Scuola Brasile
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Palo di Daniel"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. Consultato il 28 giugno 2021.