Alcuni metalli non si trovano liberi in natura e devono essere ottenuti attraverso procedure di laboratorio. Uno dei metodi efficaci ed economici per purificare i metalli è attraverso l'elettrolisi. L'elettrolisi avviene in celle elettrolitiche, con due elettrodi collegati ai terminali di un generatore di corrente continua.
È noto che in una cella elettrolitica sono presenti un catodo e un anodo, vedere la definizione per ciascuno:
catodo: È l'elettrodo negativo che attrae i cationi, ed è qui che avviene la riduzione dei cationi.
anodo: L'elettrodo positivo che attrae gli anioni e, quindi, è qui che l'anione si ossida.
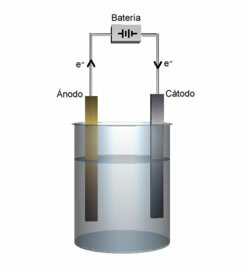
Dimostrazione di anodo e catodo.
Purificazione del rame
Il rame che si trova in natura ha impurità come argento, ferro, oro, zinco. Attraverso l'elettrolisi è possibile isolare questo metallo ottenendolo in forma pura, seguire il processo:
- Il rame impuro funge da anodo e una soluzione acquosa di solfato di rame funge da elettrolita, che si trova all'interno della cella elettrolitica. Il catodo della cella è il rame stesso in un alto grado di purezza.
- Il rame viene trasferito dall'anodo al catodo mentre le impurità rimangono in soluzione. Il rame allo stato puro si accumula al catodo e quindi può essere utilizzato.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
di Liria Alves
Laureato in Chimica
Squadra scolastica brasiliana
Vedi altro!
Reazioni di elettrolisi
Prodotti per l'elettrolisi
Elettrolisi - fisico-chimico - Chimica - Brasile Scuola
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
SOUZA, Liria Alves de. "Purificazione dei metalli mediante elettrolisi"; Brasile Scuola. Disponibile in: https://brasilescola.uol.com.br/quimica/purificacao-metais-atraves-eletrolise.htm. Consultato il 28 giugno 2021.

