Alcuni composti hanno nella loro struttura doppi legami alternati a legami singoli. Il più famoso di tutti è il benzene, la cui struttura fu proposta nel 1865 dal chimico tedesco Friedrich August Kekulé (1829-1896). La sua struttura sarebbe ciclica e formata da tre doppi legami intervallati da tre singoli legami, come mostrato nelle figure sottostanti:
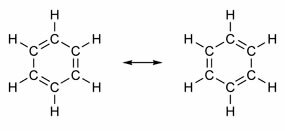
Entrambi i modi di rappresentare il benzene sono accettabili, poiché è possibile cambiare gli elettroni nei legami senza cambiare la posizione degli atomi. Tuttavia, né rappresenta esattamente ciò che è né spiega il suo comportamento. Dovrebbe comportarsi come un alchene e provocare reazioni di addizione, ma in pratica ciò non avviene. Il benzene è abbastanza stabile e si comporta come se non avesse doppi legami; dà reazioni di sostituzione come negli alcani.
Nel 1930, lo scienziato americano Linus Pauling propose la teoria della risonanza che spiegava questa apparente contraddizione. Questa teoria diceva:
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
“Ogni volta che, in una formula di struttura, possiamo cambiare la posizione degli elettroni senza cambiare la posizione degli atomi, la vera struttura no sarà nessuna delle strutture ottenute, ma piuttosto a ibrido di risonanza di quelle strutture».
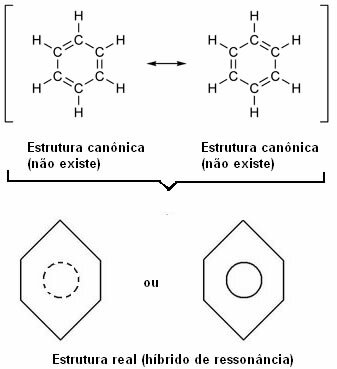
Questo effetto è evidenziato dalla dimensione dei legami di carbonio e dalla distanza tra loro. Questa distanza è intermedia a quella del legame singolo (1.54 ) ea quella del doppio legame (1.34 ); essendo quindi 1,39 Å, per effetto di risonanza.
Questo effetto è riscontrabile anche nella struttura della molecola dell'ozono (O3), come mostrato di seguito:
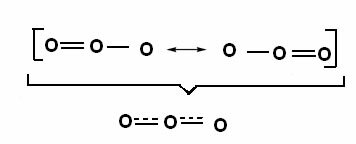
Strutture canoniche e ibridi di risonanza di ozono.
di Jennifer Fogaça
Laureato in Chimica
Squadra scolastica brasiliana.
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Risonanza nei composti chimici"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm. Consultato il 28 giugno 2021.


