IL energia di legame è coinvolto nella pausaoin allenamento di uno o più legami tra gli atomi di una molecola. La molecola del gas idrogeno, ad esempio, ha un singolo legame (sigma) tra gli atomi coinvolti:

Formula di struttura del gas idrogeno
Perché questa molecola abbia avuto origine, si è formato il singolo legame tra i suoi atomi. Quando questa molecola partecipa a una reazione chimica con cloro gassoso (Cl2), ad esempio, per la formazione di acido cloridrico (HCl), i singoli legami presenti in H2 e nel Cl2 deve essere rotto con la conseguente formazione di un unico legame nell'HCl.
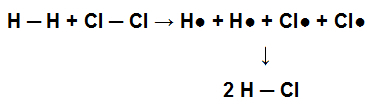
Rappresentazione della rottura dei singoli legami nel reagente e formazione di un singolo legame nel prodotto
Gli atomi si legano insieme per raggiungere il loro stabilità elettronica, cioè, passano da una situazione di energia più alta a una situazione di energia più bassa. Quindi, possiamo dire che quando si forma il legame tra gli atomi, l'energia viene rilasciata; quindi, di conseguenza, la sua rottura dipende dall'assorbimento di energia.
Se lo capiamo la separazione (rottura) di un legame chimico si verifica quando gli viene fornito una quantità di energia (xKcal), abbiamo concluso che questo è un processo Endotermico. Al contrario, la formazione di un legame comporterà la pubblicazione dà stessa quantità di energia (-xkcal), essendo, quindi, un processo esotermico.
Piace le reazioni chimiche sono classificate in endotermico o esotermico, possiamo utilizzare la conoscenza delle energie di legame delle molecole di reagenti e prodotti per determinare la variazione di energia (ΔH) del processo chimico e quindi classificarla.
Ad esempio, vedere l'equazione seguente:
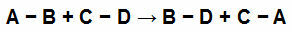
Legami chimici nei partecipanti a un'equazione chimica
Abbiamo semplici collegamenti in ciascuno dei partecipanti alla reazione. Hanno i seguenti valori:
[A-B] = 50 Kcal
[CD] = 100 Kcal
[B-D] = 80 Kcal
[AVANTI CRISTO] = 230 Kcal
Con i valori di cui sopra, possiamo calcolare l'energia coinvolta nella rottura dei legami dei reagenti e nella formazione dei legami dei prodotti come segue:
Nei reagenti
50 Kcal per rompere il legame AB e 100 Kcal per rompere il legame CD, cioè nel reagente verranno utilizzate 150 Kcal per rompere i legami.
Nei prodotti
80 Kcal per formare il legame BD e 230 Kcal per formare il legame AC, cioè 310 Kcal verranno rilasciate nel prodotto nella formazione dei legami
Con i valori delle energie coinvolte nei reagenti e prodotti, è possibile sapere se la reazione ha assorbito o rilasciato più energia semplicemente sottraendo l'energia utilizzata nell'interruzione dall'energia rilasciata nel formazione:
ΔH = Energia dei reagenti - Energia dei prodotti
ΔH = 230 - 310
ΔH = -80 Kcal
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Poiché la reazione ha più rilascio di energia che assorbimento, il ΔH negativo è quindi esotermico.
NOTA: Se il coefficiente stechiometrico del partecipante è diverso da 1, dobbiamo moltiplicare il valore energetico della connessione per il coefficiente, ad esempio:
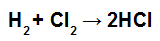
Equazione di formazione di HCl
Poiché il coefficiente di HCl è 2, dobbiamo moltiplicare il valore del legame di HCl per 2.
Ora segui la risoluzione di un esercizio sull'energia di legame in una reazione chimica:
Esempio: Date le seguenti energie di legame, in kilojoule per mole di legami (valori assoluti):
H − H = 436
N ≡ N = 945,6
N−H = 391
Calcolare il calore (in kilojoule per mole di NH3(g)) coinvolti nella reazione rappresentata da:
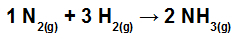
Legami chimici nella reazione di formazione di NH3
Risoluzione:
Il primo passo per risolvere questo esercizio è riscrivere l'equazione fornita dimostrando i legami chimici presenti in ciascuna delle molecole:
no no2: abbiamo un triplo legame (perché l'N, famiglia dell'Azoto, deve formare tre legami perché ha cinque elettroni nel guscio di valenza);
a H2: Abbiamo un solo legame (perché l'H deve fare un solo legame perché ha un solo elettrone nel guscio di valenza);
in NH3: Abbiamo la presenza di tre semplici legami (perché ogni H ha bisogno di un legame, e la N, tre legami).
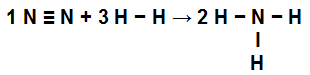
Equazione che dimostra i collegamenti nella formazione di NH3
Poiché l'esercizio ha fornito i valori per ciascun legame, il primo passo è determinare l'energia di legame relativa a ciascuno dei partecipanti:
- Per poi2
Abbiamo 1 mole nel no2nell'equazione e, per interrompere la connessione, abbiamo bisogno di 945,4 KJ, quindi:
1.945,4 = 945.4 KJ
- Alla H2
Abbiamo 3 moli nel H2nell'equazione e, per interrompere la connessione, abbiamo bisogno di 436 KJ, quindi:
3.346 = 1038 KJ
- A NH3
Abbiamo 2 moli di NH3nell'equazione, ma c'è tre volte il legame N-H, quindi moltiplichiamo la quantità di energia coinvolta per formare quel legame per 2 e per 3:
2.3.391 = 2346 KJ
Infine, possiamo determinare il calore coinvolto nella reazione sottraendo l'energia utilizzata per rompere il reagente dall'energia rilasciata nella formazione del prodotto:
ΔH = energia nei reagenti - energia nei prodotti
ΔA = (945,4 + 1038) - 2346
ΔH = 1983,4 - 2346
ΔH = - 362,6 KJ per mole di NH3(g)
Essendo la variazione negativa, significa che l'energia rilasciata nella formazione dei legami nei prodotti è stata maggiore dell'energia assorbita nella rottura dei legami dei reagenti, quindi la la reazione è esotermica.
Di Me. Diogo Lopes Dias



