Esiste una branca della scienza che studia la velocità delle reazioni chimiche e i fattori che la influenzano, si chiama Cinetica Chimica. Le reazioni chimiche possono essere definite come un insieme di fenomeni in cui due o più sostanze reagiscono tra loro, dando origine a composti diversi. Un'equazione chimica è una rappresentazione grafica di una reazione chimica, in cui i reagenti compaiono nel primo membro e i prodotti nel secondo.
LA + SI  DO + RE
DO + RE
Reagenti Prodotti
La conoscenza e lo studio delle reazioni, oltre ad essere molto importanti in termini industriali, sono anche legate alla nostra quotidianità.
La velocità di una reazione è la velocità con cui vengono consumati i reagenti o la velocità con cui si formano i prodotti. La combustione di una candela e la formazione di ruggine sono esempi di reazioni lente. Nella dinamite, la decomposizione della nitroglicerina è una reazione rapida.
Le velocità delle reazioni chimiche sono determinate attraverso leggi empiriche, chiamate leggi di velocità, dedotta dall'effetto della concentrazione di reagenti e prodotti sulla velocità di reazione.
Le reazioni chimiche avvengono a velocità diverse e queste possono essere modificate, perché oltre a concentrazione di reagenti e prodotti, le velocità di reazione dipendono anche da altri fattori piace:
Concentrazione del reagente: maggiore è la concentrazione dei reagenti, più veloce sarà la reazione. Perché avvenga una reazione tra due o più sostanze è necessario che le molecole entrino in collisione, in modo che si verifichi una rottura dei legami con la conseguente formazione di nuovi. Il numero di collisioni dipenderà dalle concentrazioni di A e B. Guarda l'immagine:
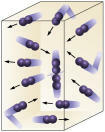
Le molecole si scontrano più spesso se
aumentiamo il numero di molecole che reagiscono.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
È facile vedere che a causa di una maggiore concentrazione ci sarà un aumento delle collisioni tra le molecole.
superficie di contatto: un aumento della superficie di contatto aumenta la velocità di reazione. Un esempio è quando dissolviamo una compressa di sonrisal schiacciata e si dissolve più velocemente che se fosse intero, questo accade perché aumentiamo la superficie di contatto che reagisce con il Acqua.
Pressione: quando si aumenta la pressione di un sistema gassoso, la velocità di reazione aumenta.
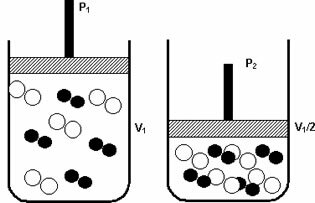
Un aumento della pressione da P1 a P2 ha ridotto il volume da V1 a V1/2, accelerando la reazione per l'avvicinamento delle molecole.
La figura sopra esemplifica, come con la diminuzione del volume nel secondo contenitore, ci sarà un aumento del pressione intensificando gli urti delle molecole e di conseguenza un aumento della velocità del reazione.
Temperatura: quando la temperatura di un sistema aumenta, si ha anche un aumento della velocità di reazione. Aumentare la temperatura significa aumentare l'energia cinetica delle molecole. Nella nostra quotidianità possiamo osservare questo fattore quando cuciniamo e aumentiamo la fiamma del fornello in modo che il cibo raggiunga il grado di cottura più velocemente.
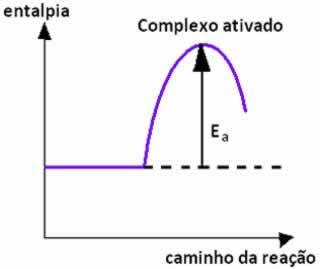
Catalizzatori: I catalizzatori sono sostanze che accelerano il meccanismo senza essere alterati in modo permanente, cioè durante la reazione non vengono consumati. I catalizzatori consentono alla reazione di seguire un percorso alternativo, che richiede meno energia di attivazione, facendo sì che la reazione proceda più rapidamente. È importante ricordare che un catalizzatore accelera la reazione, ma non aumenta la resa, cioè produce la stessa quantità di prodotto, ma in un periodo di tempo più breve.
di Liria Alves
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
SOUZA, Liria Alves de. "Cinetica chimica"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/cinetica-quimica.htm. Consultato il 27 giugno 2021.