A forze intermolecolari sono un argomento di Chimica che, di sicuro, può comparire nell'Esame Nazionale di Liceo Scientifico (E nemmeno). Pertanto, vale la pena controllare i contenuti principali di questo argomento in questo articolo.
Definizione
forze intermolecolari sono forze – di intensità variabile (debole, media o forte) – di attrazione elettrostatica o legami che si instaurano tra le molecole di una sostanza che mantengono l'unione tra loro.
Tipi di forze intermolecolari
Il) dipolo indotto
E il forza intermolecolare che si verifica tra molecole di una sostanza con una caratteristica non polare. Succede, ad esempio, tra molecole di sostanze come O2, H2, no2, CO2, CH4.
L'unione tra queste molecole avviene quando tra di esse si crea un dipolo. Ciò accade quando gli elettroni di una molecola spostano gli elettroni di un'altra, creando così un polo negativo e uno positivo, che viene trasferito da una molecola all'altra.
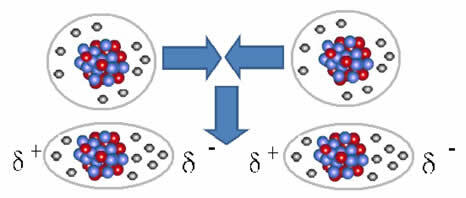
Rappresentazione della formazione di dipolo in molecole non polari
Tra queste molecole si sono formati due poli e il polo negativo dell'uno interagisce con il polo positivo dell'altro. Poiché questi poli sono stati creati, è una forza intermolecolare a bassa intensità.
B) dipolo permanente
E il forza intermolecolare che si verifica tra le molecole di una sostanza con una caratteristica polare. Esempi sono molecole di sostanze come HCN, H2O, NH3, CO, CH3cl.
L'unione tra queste molecole avviene quando il polo negativo dell'una interagisce con il polo positivo dell'altra.
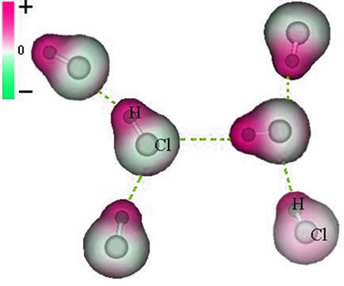
Rappresentazione della forza di dipolo permanente tra le molecole di HCl
Poiché i poli esistono già, la forza intermolecolare del dipolo permanente è di maggiore intensità rispetto al dipolo indotto.
ç) legami di idrogeno
Quella forza intermolecolare si verifica tra molecole polari che hanno un atomo di idrogeno legato direttamente a un atomo di ossigeno, azoto o fluoro.
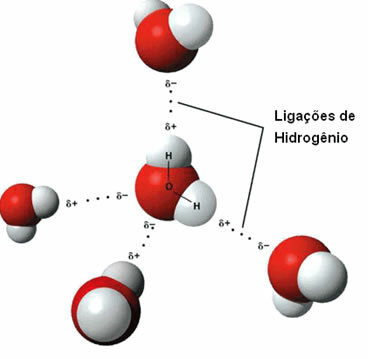
Rappresentazione dei legami idrogeno tra molecole d'acqua
Un legame idrogeno si forma quando l'idrogeno in una molecola interagisce con l'ossigeno, l'azoto o il fluoro dell'altra molecola.
d) ione dipolo
Questa forza intermolecolare si verifica tra una molecola polare, che ha una coppia di elettroni non leganti, e uno ione (catione o anione) nella soluzione.
La molecola dell'acqua, ad esempio, ha due coppie di elettroni non leganti nell'ossigeno. Se ci sono ioni nel mezzo acquoso, si avvicinano alla molecola d'acqua, poiché in essa sono presenti dei poli.
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Importanza
L'importanza di conoscere il forze intermolecolari per Enem è la comprensione che apportano riguardo agli stati fisici, punto di fusione, punto di ebollizione e solubilità delle sostanze.
Il) Relazione con il punto di fusione e di ebollizione della sostanza
Il punto di fusione indica la temperatura della transizione da uno stato solido a uno liquido e il punto di ebollizione indica la temperatura della transizione da uno stato liquido a uno gassoso.
Questo passaggio è direttamente correlato all'interazione tra le molecole della sostanza, in quanto ciò che differenzia uno stato fisico da un altro è il livello di aggregazione tra le sue molecole.
Pertanto, più intensa è la forza intermolecolare, maggiori sono i punti di fusione e di ebollizione. Meno intensa è la forza intermolecolare, più bassi sono i punti di fusione e di ebollizione. Quindi, possiamo definire l'ordine decrescente del punto di fusione e di ebollizione:
Legame idrogeno > dipolo permanente > dipolo indotto
B) Relazione con la solubilità
In generale, dobbiamo sapere che il simile dissolve il simile, cioè la sostanza polare dissolve la sostanza polare e la sostanza non polare dissolve la sostanza non polare.
Tuttavia, esiste ancora la possibilità di interazione tra le molecole di soluto e le molecole di solvente. Ciò avviene solo se questa nuova interazione è maggiore di quella già esistente tra le molecole della sostanza stessa.
Esempio di applicazione della forza intermolecolare in Enem
1° Esempio: (Enem-2011) La pelle umana, quando ben idratata, acquista una buona elasticità e un aspetto morbido e levigato. Quando è secca, invece, perde la sua elasticità e appare opaca e ruvida. Per prevenire la secchezza cutanea è necessario, ove possibile, utilizzare creme idratanti idratanti, generalmente a base di glicerina e polietilenglicole:

La ritenzione idrica sulla superficie cutanea promossa dagli idratanti è una conseguenza dell'interazione dei gruppi ossidrilici degli agenti bagnanti con l'umidità contenuta nell'ambiente attraverso:
a) legami ionici
b) forze di Londra
c) legami covalenti
d) forze dipolo-dipolo
e) legami idrogeno
La risposta a questa domanda è il legame idrogeno, poiché la molecola d'acqua ha un legame idrogeno con un atomo di ossigeno. Lo stesso accade con le molecole di glicole propilenico e glicole polietilenico, condizione favorevole all'insorgere di questo tipo di forza intermolecolare.
Di Me. Diogo Lopes Dias
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
GIORNI, Diogo Lopes. "Forze intermolecolari in Enem"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Consultato il 27 giugno 2021.