ILdeeludito è una procedura di laboratorio, industriale o domestica in cui un certo volume di solvente (puro) viene aggiunto o rimosso (per evaporazione) da una soluzione preesistente.
In qualsiasi soluzione è sempre presente un solvente e almeno un soluto, come in una miscela di 500 ml di acqua e 10 g di cloruro di sodio (NaCl) rappresentato di seguito:
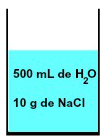
Rappresentazione della miscela formata da acqua e cloruro di sodio
Se a questa soluzione viene aggiunto un volume di 300 ml di acqua, questa procedura viene chiamata diluizione, all'aumentare del volume della soluzione – in questo caso, a 800 mL –, tuttavia, senza modificare la quantità di soluto.

Diluizione aggiungendo solvente alla soluzione salina
IL diluizione può essere eseguita anche riscaldando questa soluzione salina (composta da 500 mL di acqua e 10 g di NaCl) fino a che, ad esempio, 300 mL di acqua sono vaporizzato. In questo caso, il volume della soluzione verrebbe ridotto, tuttavia, la quantità di soluto non verrebbe modificata.

Diluizione mediante vaporizzazione del solvente in soluzione salina
Principi di diluizione:
Il volume finale della soluzione, quando viene aggiunto il solvente, è sempre maggiore del volume iniziale;
Il volume finale della soluzione, una volta rimosso il solvente, è sempre inferiore al volume iniziale;
La massa del soluto non cambia mai quando si diluisce una soluzione;
Il numero di moli del soluto non cambia mai quando si diluisce una soluzione;
Quando si aggiunge solvente ad una diluizione, la concentrazione della soluzione finale è sempre inferiore alla concentrazione della soluzione iniziale;
Quando il solvente viene rimosso in una diluizione, la concentrazione della soluzione finale è sempre maggiore della concentrazione della soluzione iniziale.
Formule utilizzate in diluizione
⇒ Calcolo del volume finale della soluzione:
Il volume della soluzione finale in una diluizione in cui viene aggiunto il solvente è calcolato dalla seguente espressione:
Vf = Vio + VIl
Vf = volume della soluzione finale
Vio = volume della soluzione iniziale
VIl= volume di solvente che è stato aggiunto
Se c'è rimozione del solvente in una diluizione, il volume finale sarà calcolato con la seguente espressione:
Vf = Vio - Ve
Ve = volume di solvente evaporato.
⇒ Calcolo di concentrazione comune:
La concentrazione della soluzione finale, dopo la diluizione, può essere calcolata come segue:
Çio.Vio = Cf.Vf
Çio= concentrazione comune della soluzione iniziale
Vio = volume della soluzione iniziale
Çf = molarità o concentrazione in mol/L della soluzione finale
Vf= volume della soluzione finale
⇒ Calcolo di molarità o concentrazione in mol/L:
La molarità della soluzione finale, dopo una diluizione, può essere calcolata con la seguente espressione:
Mio.Vio = Mf.Vf
Mio= molarità o concentrazione in mol/L della soluzione iniziale
Vio = volume della soluzione iniziale
Mf = molarità o concentrazione in mol/L della soluzione finale
Vf= volume della soluzione finale
⇒ Calcolo del titolo in blocco:
Il titolo della soluzione finale, dopo una diluizione, può essere calcolato con la seguente espressione:
Tio.mio = Tf.mf
Tio= titolo della soluzione iniziale
mio = massa della soluzione iniziale
Tf = titolo della soluzione finale
mf= massa della soluzione finale
Poiché il titolo può essere calcolato anche in percentuale e, nelle soluzioni acquose, la massa tende ad avere lo stesso valore del volume, possiamo utilizzare la seguente espressione matematica:
Pio.Vio =Pf.Vf
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Pio= percentuale della soluzione iniziale
Vio = volume della soluzione iniziale
Pf = percentuale della soluzione finale
Vf= volume della soluzione finale
Esempi di calcoli eseguiti in diluizione:
1° Esempio - (UFBA) Aggiungendo 300 mL di acqua a 100 mL di soluzione di bicarbonato di sodio all'8%, la concentrazione della soluzione ottenuta è:
a) 24% b) 18% c) 9% d) 4% e) 2%
Dati forniti dall'esercizio:
Percentuale di soluzione iniziale (Pio) = 8%
Volume della soluzione iniziale (Vio) = 100 ml
Volume della soluzione finale (Vf) = 400 mL (risultato della miscelazione da 300 mL a 100 mL)
Percentuale di soluzione finale (Pf) = ?
Per calcolare la concentrazione percentuale della soluzione, possiamo utilizzare questi valori dati nella seguente espressione:
Pio.Vio =Pf.Vf
8.100 = Pf.400
800 = Pf.400
Pf = 800
400
Pf = 2%
2° Esempio - (UFPA) 200 mL di una soluzione di idrossido di magnesio, Mg (OH)2, sono stati preparati sciogliendo 2,9 g della base in acqua. Quale volume di questa soluzione deve essere diluito a 300 mL per ottenere una soluzione con una molarità pari a 0,125 M? Dati: H = 1; mg = 24; O = 16.
a) 450 mL b) 150 mL c) 400 mL d) 300 mL e) 900 mL
Dati forniti dall'esercizio:
Massa del soluto nella soluzione iniziale (m1) = 2,9 g
Volume di soluzione da utilizzare per la diluizione = 200 mL o 0,2 L (dopo aver diviso per 1000)
Volume della soluzione iniziale (Vio) che sarà diluito = ?
Volume della soluzione finale (Vf) = 300 ml
Molarità o concentrazione in mol/L della soluzione finale (Mf) = 0,125 M
Per calcolare la concentrazione come percentuale della soluzione, dobbiamo fare quanto segue:
Passo 1: Calcola la massa molare del soluto.
Per fare ciò, dobbiamo moltiplicare il numero di atomi di ciascun elemento per la rispettiva massa atomica e quindi aggiungere i risultati:
MMg(OH)2 = 1.24 + 2.16 + 2.1
MMg(OH)2 = 24 + 32 + 2
MMg(OH)2 = 58 g/mol
Passo 2: Calcola la concentrazione in mol/L o la molarità della soluzione iniziale:
Mio = m1
MV
Mio = 2,9
58.0,2
Mio = 2,9
11,6
Mio =0,25 mol/L
Passaggio 3: Determinare il volume della soluzione che verrà diluito utilizzando i valori forniti e trovati nella seguente espressione:
Mio.Vio = Mf.Vf
0.25.Vio = 0,125.300
0.25.Vio = 37,5
Vio = 37,5
0,25
Vio = 150 ml
3° Esempio - (UEG-GO) Si consideri che 100 mL di una soluzione acquosa di solfato di rame, con una concentrazione pari a 40 g. l–1, sono stati aggiunti 400 ml di acqua distillata. In questo caso ogni ml della nuova soluzione avrà una massa, in mg, pari a:
a) 2 b) 4 c) 8 d) 10
Dati forniti dall'esercizio:
Volume di acqua aggiunta alla diluizione = 400 mL
Volume della soluzione iniziale (Vio) = 100 ml
Volume della soluzione finale (Vf) = 500 mL (risultato della miscelazione da 400 mL a 100 mL)
Concentrazione comune della soluzione iniziale (Cio) = 40 gr. l–1
Concentrazione comune della soluzione finale (Cf) in mg/ml= ?
Per calcolare la concentrazione della soluzione in mg/mL, dobbiamo fare quanto segue:
Passo 1: Convertire la concentrazione della soluzione iniziale da g/L a mg/mL.
Per fare ciò, dobbiamo moltiplicare sia il numeratore che il denominatore per 1000 e dividere semplicemente la concentrazione data per 1000:
Çio = 40g 1000
1 litro 1000
Çio = 40 mg/ml
Pertanto, le unità g/L e mg/mL sono le stesse.
Passo 2: Calcolare la concentrazione in mg/mL utilizzando i valori forniti nella seguente espressione:
Çio.Vio = Cf.Vf
40,100 = Cf.500
4000 = Cf.500
Çf = 4000
500
Çf = 8 mg/ml
Di Me. Diogo Lopes Dias
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
GIORNI, Diogo Lopes. "Cos'è la diluizione?"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-diluicao.htm. Consultato il 28 giugno 2021.