La materia può subire due tipi principali di trasformazioni, fisiche e chimiche. La trasformazione fisica avviene quando la natura della materia non viene modificata, cioè la sua composizione. Ad esempio, quando abbiamo tagliato un pezzo di legno, ha subito una trasformazione, ma è stato un fenomeno fisico, perché è ancora legno, la sua costituzione è la stessa dell'inizio.
D'altro canto, una trasformazione o un fenomeno chimico si verifica quando la natura o la composizione della materia viene modificata. In questo caso, le particelle iniziali (che possono essere molecole, atomi, cluster ionici, ioni, ecc.) sono come smontati e i loro atomi si riorganizzano, assemblando nuove molecole, cluster, atomi, ioni ecc., cioè nuovi sostanze. Questo è un reazione chimica.
Ad esempio, immaginiamo di avvicinare un fiammifero acceso all'alcol etilico. Sappiamo cosa accadrà: l'alcol inizierà a bruciare. Ciò significa che sta subendo una reazione chimica con l'ossigeno nell'aria (O2) e cambierà la sua composizione, non essendo più etanolo (C
2H6O), e anche l'ossigeno non avrà più la sua composizione iniziale, dando origine a nuove sostanze, che sono l'anidride carbonica (CO2) e acqua (H2O).
Alcool in fiamme - reazione di combustione
Nelle reazioni chimiche, le sostanze iniziali sono chiamate reagenti e la fine di prodotti, e le reazioni sono rappresentate attraverso equazioni chimiche, che seguono la seguente struttura generale:
REAGENTI → PRODOTTI
Considerando l'esempio precedente della reazione di combustione completa dell'alcol (etanolo), abbiamo la seguente equazione chimica:
Etanolo + Ossigeno → Anidride carbonica + Acqua
Questa reazione chimica è rappresentata di seguito per mezzo di atomi secondo il modello Dalton, sotto forma di sfere semplici:
Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
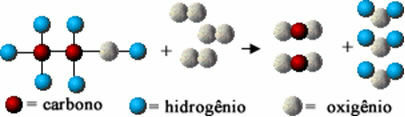
Rappresentazione del modello di una reazione di combustione dell'etanolo
Notare che i legami iniziali tra gli atomi si sono rotti e hanno formato nuovi legami e sono apparse nuove sostanze.
Pertanto, le equazioni chimiche vengono scritte utilizzando formule e simboli che rappresentano al meglio lo schema sopra. Nel caso considerato (reazione di combustione dell'etanolo), abbiamo che l'equazione chimica è espressa come segue:
Ç2H5Oh(?) + 3 O2(g) → 2 CO2(g) + 3 H2oh(v)
Ci sono alcuni fattori visivi che indicano che c'è stata una reazione chimica, che sono:
* Rilascio di gas;
* Cambio di colore;
* Formazione di precipitati;
* Aspetto di fiamma o luminosità.
Importanti processi che avvengono nel nostro corpo, in natura e nelle industrie, come la produzione di medicinali e alimenti industrializzati, sono reazioni chimiche. Pertanto, sono estremamente importanti per l'emergere e il mantenimento della vita.
Esistono diversi tipi di reazioni chimiche, classificabili secondo vari criteri, ma le principali tipologie studiate in chimica sono:
1. Reazioni inorganiche: Di solito sono classificati in base al numero di sostanze formate, al numero di reagenti e alla presenza o assenza di sostanze semplici e composte. Esistono quattro tipi principali di reazioni inorganiche:
1.1. Sintesi o reazioni di addizione;
1.2. Decomposizione o reazione di analisi;
1.3. Scambio semplice, spostamento o reazione redox;
1.4. Doppio scambio o reazione di metatesi;
2. Reazioni organiche: Questi sono quelli che coinvolgono i composti del carbonio. Sono generalmente classificati in tre tipi principali:
2.1. Reazioni di addizione;
2.2. Reazioni di sostituzione;
2.3. Reazioni di eliminazione.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Cos'è una reazione chimica?"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-reacao-quimica.htm. Consultato il 28 giugno 2021.
Che cos'è la chimica?

Comprendere cos'è Kp, la costante di equilibrio in termini di pressione, e sapere come ottenerla utilizzando le pressioni parziali di tutti i gas presenti in un equilibrio chimico, che può essere in atmosfere (atm) o millimetri di mercurio (mmHg). Clicca qui e scopri di più su questo argomento!